
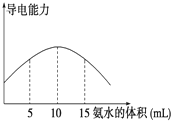
 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
| 0.2×10 |
| 20 |
| 0.2×10 |
| 20 |
| 10 -3 |
| 0.1 |


 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酸、碱、盐、氧化物在组成上的共同点是都含有非金属元素 |
| B、只含有一种元素的物质不一定都是纯净物 |
| C、电离产生H+的化合物叫酸,其分子中氢原子的个数即是该酸的元数 |
| D、压强恒定时,气体在水中的溶解度随温度的升高而降低 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com