
| A、Na+、NH4+、H+、NO3- |
| B、K+、Ca2+、HCO3-、NO3- |
| C、Na+、Mg2+、Cl-、NO3- |
| D、Na+、Ba2+、NO3-、Cl- |


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
| A、盐酸、空气、醋酸、干冰 |
| B、漂白粉、胆矾、氯化钾、硫酸钡 |
| C、蛋白质、油脂、苛性钾、碳酸钙 |
| D、福尔马林、冰醋酸、硫酸钠、乙醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碳酸钙能够溶解在二氧化碳的水溶液中 |
| B、氢氧化镁可溶于盐酸不溶于氯化铵溶液 |
| C、氯化银可溶于氨水 |
| D、硫酸镁溶液中滴加氢氧化钡得到两种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、装有尾气净化装置的汽车排出的气体中不再含有NO或CO |
| B、提高尾气净化效率的常用方法是升高温度 |
| C、增大压强,上述平衡右移,故可通过增压的方法提高尾气净化效率 |
| D、提高尾气净化效率的最佳途径是使用高效催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
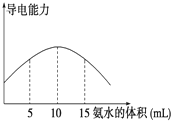 电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )
电离度是描述弱电解质电离程度的物理量,电离度=(已电离的电解质的物质的量/原来总的物质的量)×100%.现取20mL pH=3的 CH3COOH溶液,加入0.2mol?L-1的氨水,测得溶液导电性变化如图,则加入氨水前CH3COOH的电离度为( )| A、0.5% | B、1.5% |
| C、0.1% | D、1% |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若溶液M呈强酸性,则N中一定含有OH-、NO3- |
| B、若溶液N呈强酸性,则N中一定含有Al3+、可能含有Na+ |
| C、若溶液N无色,则N中一定不含有Fe3+、Cl-,且溶液M有强氧化性 |
| D、常温下,若M、N两溶液混合后pH=7,则至少生成三种沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、分子晶体中一定不含离子键,但一定存在共价键 |
| B、金属与非金属元素形成的化合物一定是离子化合物 |
| C、NCl3分子中所有的原子均为8电子稳定结构 |
| D、NaHSO4晶体中阴、阳离子的个数比是1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
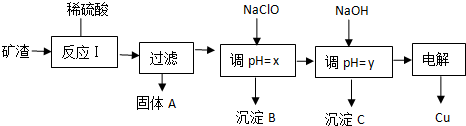
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com