
����Ŀ����ҵ�����õ�ⱥ��ʳ��ˮ��������(Cl2)���ռ�������Ļ�ѧ����ʽ��2NaCl+2H2O![]() 2NaOH+Cl2��+H2����
2NaOH+Cl2��+H2����
��1�����ʳ��ˮ�Ĺ����У�����������____________________����˫���ű�ʾ������ת�Ƶķ������Ŀ________________������з�Ӧ��д�����ӷ���ʽ��_____________��
��2��ʵ������______________��Һ���ѧʽ�����������������������Ⱦ������д����ѧ����ʽ___________________________________________________��
��3�����ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+��Mg2+���������ӡ�����ʱ���μ���BaCl2��Һ��Na2CO3��NaOH����ַ�Ӧ����ˣ�����Һ�м��������к������ԡ���������Һ��Ӧ�����ӷ���ʽ__________��
���𰸡�Cl2 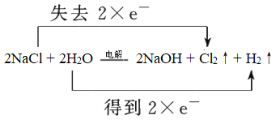 2Cl-+2H2O
2Cl-+2H2O![]() 2OH-+Cl2��+H2�� NaOH Cl2+2NaOH��NaCl+NaClO+H2O H++OH-��H2O��2H++CO32-��H2O+CO2��
2OH-+Cl2��+H2�� NaOH Cl2+2NaOH��NaCl+NaClO+H2O H++OH-��H2O��2H++CO32-��H2O+CO2��
��������
��1����Ӧ����Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ���Ԫ�ػ��ϼ۴�+1�۽��͵�0�ۣ���ϵ��ӵ�ʧ�غ�ͷ���ʽ�������
��2���������������Һ��Ӧ�����жϣ�
��3��������Һ�к���̼���ƺ��������Ʒ�����
��1����Ӧ����Ԫ�ػ��ϼ۴ӣ�1�����ߵ�0�ۣ�ʧȥ1�����ӣ��Ȼ����ǻ�ԭ����������������������ݷ���ʽ��֪��Ӧת��2�����ӣ�����˫���ű�ʾ������ת�Ƶķ������ĿΪ ���÷�Ӧ�����ӷ���ʽΪ2Cl-+2H2O
���÷�Ӧ�����ӷ���ʽΪ2Cl-+2H2O![]() 2OH-+Cl2��+H2����
2OH-+Cl2��+H2����
��2�������ж���ʵ������NaOH��Һ���������������������Ⱦ��������Ӧ�Ļ�ѧ����ʽΪCl2+2NaOH��NaCl+NaClO+H2O
��
��3�����ʳ��ˮҪ��Դ�ʳ��ˮ���о��ƣ��Գ�ȥ��ʳ��ˮ�к��е���ɳ��SO42-��Ca2+��Mg2+���������ӡ�����ʱ���μ����Ȼ�����Һ����ȥ��������ӣ����봿���ȥ�����Ӻ����ı����ӣ������ռ��ȥþ���ӣ���ַ�Ӧ����ˣ���Һ����Ҫ���й�����̼���ƺ��������ƣ����������к������ԣ���Ӧ�����ӷ���ʽ��H++OH-��H2O��2H++CO32-��H2O+CO2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������������Ӧ�Ļ�ѧ����ʽ���ж��й����ʵĻ�ԭ�Ե�ǿ��˳��Ϊ�� ��
��I2+ SO2+ 2H2O =H2SO4+ 2HI ��2FeCl2+ Cl2= 2FeCl3
��2FeCl3+ 2HI =2FeCl2+ I2+ 2HCl
A. I-�� Fe2+��Cl-��SO2 B. Cl-�� Fe2+�� SO2��I-
C. Fe2+��I-��Cl-��SO2 D. SO2��I-�� Fe2+��Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڳ�����pH=1��������Һ���й�������
�ٸ���Һ1mLϡ����100mL��pH=3
�������Һ�м���������pH=13������������Һǡ����ȫ�к�
�۸���Һ������������c(H+)��ˮ�������c(H+)֮��ֵΪ1��10��12
�������Һ�м�����������Ũ�ȵİ�ˮ��������ҺpH=7
������ȷ����
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ������װ�ý����й�Cl2��ʵ�顣����˵������ȷ����


A. ��ͼ�У�ʵ������֤��������Ư�����ã���ˮ��Ư������
B. ��ͼ�У���Cl2����ζ
C. ��ͼ�У������ػ�ɫ����
D. ��ͼ�У�������ɱ�֤��Cl2����NaOH��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��������ˮ�������Һ��pH����7���û�����( )
A.KNO3B.NH4NO3C.(NH4)2SO4D.K2CO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Թ���ʢ��������ɫ���壬��������Σ�����ķ�����
A����ˮ����ʪ��ĺ�ɫʯ����ֽ�����Թܿ�
B����NaOH��Һ�����ȣ������̪�Լ�
C����NaOH��Һ�����ȣ�������ɫʯ���Լ�
D����NaOH��Һ�����ȣ���ʪ��ĺ�ɫʯ����ֽ�����Թܿ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ʵ�ˮ��Һ���ܵ����Cl�����ǣ�������
A.HCl
B.NaClO
C.MgCl2
D.NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������������
A. �ý����ƿ������Ҵ�������
B. �ø������������Һ�����ּ����3-��ϩ
C. ��ˮ�����ֱ����屽
D. �����Ƶ�������Һ�����ּ����������ȩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ˮ����þ(MgSO4��7H2O)Ϊ��ɫϸС�Ľ���״�ᾧ������ζ�࣬��ӡȾ����ֽ��ҽҩ�ȹ�ҵ�϶��й㷺��Ӧ�ã����û�����������ɰ�ķ���һ��þ�����ȡ��ˮ����þ����þ�����Ҫ�ɷ���MgCO3����������������(MgO��SiO2��Fe2O3��CaO��B2O3��Al2O3��MnO��)��
��1����������������������ʽ��ȫ����ʱ��Һ��pH
������ | Al(OH)3 | Fe(OH)3 | Fe(OH)3 | Mn(OH)2 | Mg(OH)2 |
pHֵ | 4.7 | 3.2 | 9.7 | 10.4 | 11.2 |
��2�����ε��ܽ��(��λΪg/100gˮ)
�¶�/�� | 10 | 30 | 40 | 50 | 60 |
CaSO4 | 0.19 | 0.21 | 0.21 | 0.20 | 0.19 |
MgSO4��7H2O | 30.9 | 35.5 | 40.8 | 45.6 | �� |
��þ����ȡ��ˮ����þ�Ĺ�����������

������������ͼ���ο��������ݣ��Իش��������⣺
(1)�����ܹ����У���ӿ������ٶȣ�������ֿ��еĴ�ʩ_______________��
(2)����A�г����������⣬����������(H3BO3)����������ˮ��ΪһԪ���ᣬ�����Բ���Դ���ǻ��ĵ��룬д������ˮ��Һ���뷽��ʽspan>_____________________
(3)���Գ���B���з������������к��ж������̣������ӷ���ʽ���Ͳ�����������ԭ��__________________��
(4)������þ�����pH=5��6Ŀ����________________��
(5)�õ��ij���C�������_________________(�ѧʽ)�����ˢ�����ȹ��ˣ�ԭ����___________��
(6)������ˢ�����Һ���Ƿ���Fe3+��ʵ�鷽����____________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com