
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下。
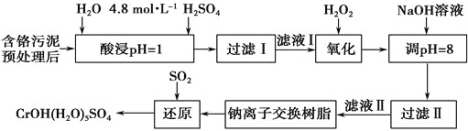
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有______________![]() 答出两点
答出两点![]() 。
。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 |
|
|
|
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_______________。
(4)写出上述流程中用SO2进行还原时发生反应的化学方程式: ____________。
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol/L的HCl溶液滴定至溶液由红色变为无色![]() 指示
指示![]() 反应的终点
反应的终点![]() ,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
【答案】加热升高反应温度 、增大固体颗粒的表面积 ![]()
![]() 、
、![]() 、
、![]()
![]() 超过8会使部分
超过8会使部分![]() 溶解生成
溶解生成![]() ,最终影响
,最终影响![]() Ⅲ
Ⅲ![]() 的回收与再利用
的回收与再利用 ![]()
![]()
【解析】
含铬污泥预处理后,用过硫酸浸取金属离子,硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,加入过氧化氢氧化Cr3+为高价态,加入氢氧化钠溶液调节溶液的pH=8,使其他离子沉淀,过滤得到滤液用Na+交换树脂交换Mg2+和Ca2+,得到的溶液中通入SO2还原得到Cr(OH)(H2O)5SO4;
(1)硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+,酸浸是溶解物质为了提高浸取率,可以升高温度增大物质溶解度,增大接触面积增大反应速率,或加快搅拌速度等;
(2)根据H2O2的性质分析,H2O2有强氧化性,能氧化还原性的物质,依据电荷守恒、原子守恒书写离子方程式;
(3)溶液碱性过强,OH-与Al(OH)3反应;
(4)依据流程图中的转化关系和产物,结合SO2的还原性,利用氧化还原反应原理分析书写;
(5)加酚酞作指示剂,指示CO32-+H+=HCO3-的滴定终点,再加甲基橙,指示HCO3-+H+=CO2↑+H2O的滴定终点,样品中含有的NaHCO3反应消耗盐酸体积为(V2-V1)mL,消耗盐酸的物质的量为![]() mol,因此NaHCO3的物质的量为
mol,因此NaHCO3的物质的量为![]() mol,以此来计算NaHCO3的质量分数。
mol,以此来计算NaHCO3的质量分数。
(1)酸浸时,为了提高浸取率可采取的措施是:加热升高反应温度;增大固体颗粒的表面积;
(2)双氧水有强氧化性,能氧化还原性的物质,Cr3+ 有还原性 ,Cr3+ 能被双氧水氧化为高价离子,以便于与杂质离子分离,离子方程式为:![]() ;
;
(3)硫酸浸取液中的金属离子主要是Cr3+,其次是 Fe3+、Al3+、Ca2+和Mg2+, 加入过氧化氢氧化铬离子为Cr2O72-,加入 NaOH 溶液使溶液呈碱性,Cr2O72-转化为CrO42-, 溶液pH=8,Fe3+、Al3+沉淀完全 , 滤液Ⅱ中阳离子主要Na+、Ca2+和Mg2+;超过pH=8,氢氧化铝是两性氢氧化物会溶解于强碱溶液中影响铬离子的回收利用;
(4)二氧化硫具有还原性 , 被滤液Ⅱ中通过离子交换后的溶液中Na2CrO4氧化为硫酸,a2CrO4被还原为Cr(OH)(H2O)5SO4,水溶液中生成氢氧化钠溶液和硫酸反应生成硫酸钠,反应的方程式为: ![]() ;
;
(5)根据题意,纯碱中含有的碳酸氢钠的物质的量为![]() mol,纯碱样品中NaHCO3质量分数为:
mol,纯碱样品中NaHCO3质量分数为:![]() 。
。


 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】中科大陈乾旺教授等人发明合成金刚石的新方法,其化学原理是:①Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:②C(石墨)
C(金刚石)+C(石墨)+Na2CO3(未配平),该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:②C(石墨)![]() (金刚石)。以下表述正确的是( )
(金刚石)。以下表述正确的是( )
A.金刚石属于原子晶体
B.反应①中各物质熔沸点高低顺序为:金刚石﹥石墨﹥Na2CO3﹥Na﹥CO2
C.石墨晶体中,既有共价键,又有范德华力,但没有金属键
D.干冰晶体中,与1个CO2分子紧邻且等距的CO2分子有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子交换法净化水过程如图所示。下列说法中错误的是

A. 经过阳离子交换树脂后,水中阳离子的总数不变
B. 水中的![]() 、
、![]() 、Cl通过阴离子树脂后被除去
、Cl通过阴离子树脂后被除去
C. 通过净化处理后,水的导电性降低
D. 阴离子树脂填充段存在反应H++OH![]() H2O
H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,对下列叙述的判断正确的是( )
A.甲中水电离出来的H+的物质的量浓度是乙中水电离出来H+的物质的量浓度的10倍
B.中和等物质的量的NaOH溶液需甲、乙两杯醋酸溶液的体积,10V(甲)>V(乙)
C.物质的量浓度c(甲)>10c(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联胺是火箭的燃料,一种用联胺制成的燃料电池示意图如下,下列有关该电池说法正确的是 ![]()
![]()
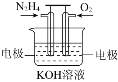
A.该电池工作时电子从负极经电解质溶液到正极
B.电池工作一段时问后,溶液的pH减小
C.负极的反应为N2H4-4e-=N2↑+4H+
D.当电路中通过![]() 的电子时,负极消耗0.56L的氧气
的电子时,负极消耗0.56L的氧气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将CO2通入2LpH=12的KOH溶液中,溶液中水电离的OH-离子浓度(φ)与通入的CO2的体积(V)的关系如下图所示。下列叙述不正确的是

A.a点溶液中:水电离出的c(H+)=1×10-12mol/L
B.b点溶液中:c(H+)=1×10-7mol/L
C.c点溶液中:c(K+)=2[c(CO32-)+c(HCO3-)+c(H2CO3)]
D.d点溶液中:c(K+)=2c(CO32-)+c(HCO3-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用碱性氢氧燃料电池为电源进行电解的实验装置示意图如图所示。下列说法中正确的是( )
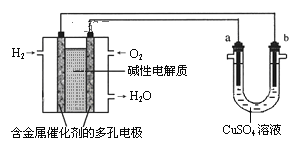
A.燃料电池工作时负极反应为:H2=2H++2e-
B.若要实现铁上镀铜,则a极是铁,b极是铜
C.若要实现电解精炼粗铜,则a极发生氧化反应,b极上有铜析出
D.a、b两极均是石墨时,在相同条件下,当电池中消耗H222.4L(标准状况)时,a极析出铜64g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol1)可用作定影剂、还原剂。回答下列问题:
(1)已知:Ksp(BaSO4)=1.1×1010,Ksp(BaS2O3)=4.1×105。市售硫代硫酸钠中常含有硫酸根杂质,选用下列试剂设计实验方案进行检验:
试剂:稀盐酸、稀H2SO4、BaCl2溶液、Na2CO3溶液、H2O2溶液
完成下列表格
实验步骤 | 现象 |
①取少量样品,加入除氧蒸馏水 | ②固体完全溶解得无色澄清溶液 |
③加入过量稀盐酸 | ④___________,有刺激性气体产生 |
⑤静置,(吸)取上层清液,滴入BaCl2溶液 | ⑥_______________________________ |
(2)利用K2Cr2O7标准溶液定量测定硫代硫酸钠的纯度。测定步骤如下:
①溶液配制:称取1.2000 g某硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后,全部转移至100 mL的_________中,加蒸馏水至刻线。
②滴定:用___________________取0.00950 mol·L1的K2Cr2O7标准溶液20.00 mL,硫酸酸化后加入过量KI,发生反应: Cr2O72—+6I+14H+=3I2+2Cr3++7H2O。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32—=S4O62—+2I。加入淀粉溶液作为指示剂,继续滴定,当溶液_____________________,即为终点。平行滴定3次,样品溶液的平均用量为24.80 mL,则样品纯度为_________%(保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知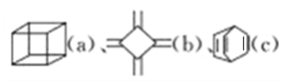 的分子式均为C8H8,下列说法正确的是( )
的分子式均为C8H8,下列说法正确的是( )
A.c可与酸性高锰酸钾溶液反应,a和b不行
B.a、b 的二氯代物均有3种,c的二氯代物有6种
C.a的同分异构体中除b、c外,还可以是苯的同系物
D.a、b、c中只有b、c的所有原子处于同一平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com