
【题目】中科大陈乾旺教授等人发明合成金刚石的新方法,其化学原理是:①Na+CO2![]() C(金刚石)+C(石墨)+Na2CO3(未配平),该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:②C(石墨)
C(金刚石)+C(石墨)+Na2CO3(未配平),该方法比1955年人工首次制得金刚石的旧方法容易得多,其化学原理是:②C(石墨)![]() (金刚石)。以下表述正确的是( )
(金刚石)。以下表述正确的是( )
A.金刚石属于原子晶体
B.反应①中各物质熔沸点高低顺序为:金刚石﹥石墨﹥Na2CO3﹥Na﹥CO2
C.石墨晶体中,既有共价键,又有范德华力,但没有金属键
D.干冰晶体中,与1个CO2分子紧邻且等距的CO2分子有6个
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】pH是溶液中![]() 的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸
的负对数,若定义pC是溶液中微粒物质的量浓度的负对数,则常温下,某浓度的草酸![]() 水溶液中
水溶液中![]() ,
,![]() 、
、![]() 随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是
随着溶液pH的变化曲线如图所示。下列说法 不 正 确的是

A.曲线Ⅰ代表![]() 的浓度随着pH增大先变小后变大
的浓度随着pH增大先变小后变大
B.草酸的电离常数![]() ;
;![]()
C.![]() 时,
时,![]()
D.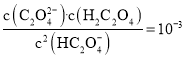
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中,不能用勒夏特列原理解释的是( )
A.红棕色的NO2,加压后颜色先变深后变浅
B.滴加酚酞的氨水中加入氯化铵固体后红色变浅
C.煅烧粉粹的硫铁矿有利于SO2的生成
D.黄绿色的氯水光照后颜色变浅
查看答案和解析>>
科目:高中化学 来源: 题型:
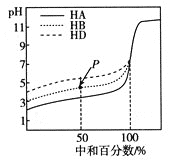
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的等体积的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示:
请按要求回答下列问题:
(1)三种酸的电离常数分别为KHA、KHB、KHD,其中最大的是_________。
(2)当滴定至P点时,该溶液中各种离子浓度由大到小依次是________________。
(3)若分别滴定到pH=7,此时三种溶液中的主要阴离子浓度大小关系为___________。
(4)当中和百分数达100%时,所需n(NaOH)的大小关系是___________;若将此时的三种溶液混合,其中的c(OH-)=___________(用溶液中其他粒子的浓度表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)键线式![]() 的系统命名为 __________________;
的系统命名为 __________________;
(2) 中含有的官能团为_______________;
中含有的官能团为_______________;
(3)2-甲基-1-丁烯的结构简式____________________;
(4)相对分子质量为 72 且一氯代物只有一种的烷烃的结构简式________________;
(5)分子式为 C2H6O 的有机物,有两种同分异构体,乙醇(CH3CH2OH)、甲醚(CH3OCH3),则通过下列方法,不可能将二者区别开来的是________________;
A.红外光谱 B.核磁共振氢谱 C.质谱法 D.与钠反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓度均为![]() 、体积均为
、体积均为![]() 的HX、HY溶液,分别加水稀释至体积为V,pH随
的HX、HY溶液,分别加水稀释至体积为V,pH随![]() 的变化关系如图所示。下列叙述不正确的是
的变化关系如图所示。下列叙述不正确的是![]()
![]()
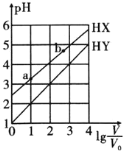
A.HY的酸性强于HX
B.HX的电离程度:![]()
C.若两溶液无限稀释,则它们的![]() 相等
相等
D.当![]() 时,若两溶液同时升高温度,则
时,若两溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】右表为元素周期表中短周期的一部分,Y元素最高正价与最低负价的代数和为4,下列叙述正确的是
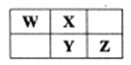
A. 原子半径: W B. 元素的非金属性:X>Y>Z
C. 氢化物的热稳定性:W>X D. 氧化物对应水化物的酸性: Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理可以对工厂排放的废水、废渣等进行有效检测与合理处理。某工厂对制革工业污泥中Cr(III)的处理工艺流程如下。
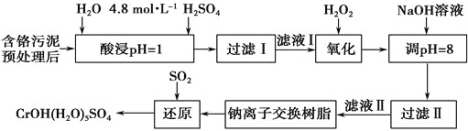
其中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Ca2+和Mg2+。
(1)酸浸时,为了提高浸取率可采取的措施有______________![]() 答出两点
答出两点![]() 。
。
(2)H2O2的作用是将滤液Ⅰ中的Cr3+转化为Cr2O72-,写出此反应的离子方程式:_____________。
(3)常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下:
阳离子 | Fe3+ | Mg2+ | Al3+ | Cr3+ |
开始沉淀时的pH | 2.7 |
|
|
|
沉淀完全时的pH | 3.7 | 11.1 | 8 | 9(>9溶解) |
加入NaOH溶液使溶液呈碱性,Cr2O72-转化为CrO42-。滤液Ⅱ中阳离子主要有________;但溶液的pH不能超过8,其理由是_______________。
(4)写出上述流程中用SO2进行还原时发生反应的化学方程式: ____________。
(5)滴定法测定纯碱产品中NaHCO3含量的方法是:准确称取纯碱样品Wg,放入锥形瓶中加蒸馏水溶解,加1~2滴酚酞指示剂,用cmol/L的HCl溶液滴定至溶液由红色变为无色![]() 指示
指示![]() 反应的终点
反应的终点![]() ,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
,所用HCl溶液体积为V1mL,再加1~2滴甲基橙指示剂,继续用HCl溶液滴定至溶液由黄色变为橙色,所用HCI溶液总体积为V2mL,则纯碱样品中NaHCO3质量分数为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com