
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 molL-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
(1)SO2+OH—=HSO3—;因有HSO3—存在,HSO3—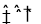 H++SO32—和HSO3—+H2O
H++SO32—和HSO3—+H2O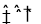 H2SO3+OH—,HSO3—电离强于水解(2分);
H2SO3+OH—,HSO3—电离强于水解(2分);
HSO3—+H2O—2e—=SO42—+3H+(2分);
(2)c(Na+)>c(SO32—)>c(OH—)>c(HSO3—)>c(H+)(2分);减小;
(3)B;S2O32—+5H2O+4Cl2+2Ba2+=2BaSO4+8Cl—+10H+(2分);
(4)①否;酸式;②偏低;③96.9%(2分)
【解析】
试题分析:(1)由已知:n(NaOH)=1 molL-1 × 0.1L=0.1mol
n(SO2)=0.1mol,则SO2+OH-=HSO3-;
亚硫酸氢钠溶液呈酸性因为:HSO3-H++SO32-,HSO3-+H2OH2SO3+OH-
其中电离程度大于水解程度,故亚硫酸氢钠溶液呈酸性;
以石墨作电极,电解该物质的饱和溶液时,阳极H+放电会生成H2,则阳极无气体应为HSO3-放电,电极反应式为:HSO3-+H2O-2e-=SO42-+3H+;
(2)Na2SO3溶液中,SO32-水解显碱性,离子浓度大小比较为:c(Na+)>c(SO32-)>c(OH-)>c(HSO3-)>c(H+),Na2SO3溶液放置于空气中一段时间后被氧化:2Na2SO3+O2=2Na2SO4,溶液从碱性变化为中性,pH减小;
(3)由已知:实验①测定溶液pH=8:
A.溶液pH=8,呈碱性,则c水(OH-)=10-6mol/L,故A错误;
B.S2O32-水解显碱性,证明H2S2O3是弱酸,故B正确;
C.Na2S2O3是钠盐为强电解质,故C错误;
D.H2S2O3为二元弱酸,S2O32-水解应分步进行,故D错误;
实验②Cl2将Na2S2O3氧化为Na2SO4,加BaCl2生成BaSO4反应的离子方程式:
S2O32-+5H2O+4Cl2+Ba2+=2BaSO4↓+8Cl-+10H+;
(4)①由于高锰酸钾溶液呈紫红色可作指示剂,当滴入最后一滴溶液呈紫红色,半分钟不褪色,即可指示出滴定终点。因此不需要指示剂。高锰酸钾为强氧化性溶液,可使用酸式滴定管;
②刚看到溶液局部变色就停止滴定,反应并未达到滴定终点,测得的高锰酸钾溶液体积偏低,因此测量结果会偏低;
③n(KMnO4)=0.40mol/L ×0.020L=0.008mol,则由反应方程式:
5S2O32-+8MnO4-+14H+=8Mn2++10SO42-+7H2O
5 8
n 0.008mol
n=0.005mol
产品中Na2S2O35H2O的质量分数=0.005mol×248g/mol/1.28g×100%=96.9%,
考点:了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。了解化学实验是科学探究过程中的一种重要方法。了解化学实验室常用仪器的主要用途和使用方法。能做到设计、评价或改进实验方案。


科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高二上学期期末化学试卷(解析版) 题型:选择题
下列各组离子能大量共存于同一溶液中的是
A.Ba2+、Mg2+、Cl-、CO32-
B.Fe3+、K+、I-、SO42-
C.K+、NH4+、NO3—、OH—
D.Al3+、NH4+、NO3—、Cl—
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
某同学用下图所示的装置及药品进行比较酸性强弱的实验,一段时间后试管②中有胶冻状物质生成。下列说法正确的是
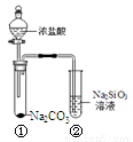
A.向Na2SiO3溶液中滴入酚酞溶液无明显现象
B.试管①中反应的离子方程式是:Na2CO3+ 2H+ == 2Na+ + CO2↑+ H2O
C.该实验可以证明酸性:盐酸>碳酸>硅酸
D.若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:填空题
(14分)CO2作为未来碳源,既可弥补因石油、天然气等大量消耗引起的“碳源危机”,又可有效地解决温室效应。请回答下列问题:
(1)将所得CH4与H2O(g)通入聚焦太阳能反应器,发生反应CH4(g)+H2O(g) CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
CO(g)+3H2(g) △H = +206 kJ·mol-1。将等物质的量的CH4和H2O(g)充入2 L恒容密闭容器,某温度下反应5 min后达到平衡,此时测得CO的物质的量为0.10 mol,则5 min内H2的平均反应速率为 。平衡后可以采取下列 的措施能使n(CO):n(CH4)增大。
A.加热升高温度
B.恒温恒容下充入氦气
C.恒温下增大容器体积
D.恒温恒容下再充入等物质的量的CH4和H2O
(2)工业上可以利用CO为原料制取CH3OH。
已知:CO2(g)+3H2(g) CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CH3OH(g) +H2O(g) △H=-49.5 kJ·mol-1
CO2(g)+H2(g) CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
CO(g)+H2O(g) △H= + 41.3 kJ·mol-1
①试写出由CO和H2制取甲醇的热化学方程式 。
②该反应的△S 0(填“>”或“<”或“=”),在 情况下有利于该反应自发进行。
(3)某科研人员为研究H2和CO合成CH3OH的最佳起始组成比n(H2) : n(CO),在l L恒容密闭容器中通入H2与CO的混合气(CO的投入量均为1 mol),分别在230°C、250°C和270°C进行实验,测得结果如下图,则230℃时的实验结果所对应的曲线是 (填字母);理由是 。列式计算270℃时该反应的平衡常数K: 。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高三上学期第三次统练理综化学试卷(解析版) 题型:选择题
X、Y、Z、W为原子序数依次增大的短周期元素。其形成的小分子化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构。下列说法正确的是
A.X、Y、Z、W的原子半径的大小关系为:W> Y >Z> X
B.在化合物Y2X2、Z2X4、X2W2中,分子所含的共用电子对数相等
C.与元素Y、Z相比,元素W形成的简单氢化物最稳定,是因为其分子间存在氢键
D.X、Y、Z、W四种元素可形成化学式为X7Y2ZW2的有机物
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
含有砒霜(As2O3)的试样和锌、盐酸混合反应,生成的砷化氢(AsH3)在热玻璃管中完全分解成单质砷和氢气。若砷的质量为1.50 mg,则
A.被氧化的砒霜为l.98 mg B.分解产生的氢气为0.672 mL
C.和砒霜反应的锌为3.90 mg D.转移的电子总数为6×10—5NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:选择题
某溶液可能含有Cl—、SO42—、CO32—、NH4+、Fe3+、Fe2+、Al3+和Na+。某同学为了确定其成分,取部分试液,设计并完成了如下实验:

下列说法正确的是
A.原溶液中c(Fe3+)=0.2 mol·L—1
B.原溶液中至少有4种离子存在,其中Cl—一定存在,且c(Cl—)≥0.2 mol·L—1
C.原溶液中SO42—、NH4+、Na+一定存在,CO32—、Al3+一定不存在
D.要确定原溶液中是否含有Fe2+,其操作为:取少量原溶液于试管中,加入适量氯水,无现象,再加KSCN溶液,溶液呈血红色,则含有Fe2+
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:填空题
铝是第二金属,是地壳中含量最多的金属,用途广泛。
51.1.将某铝土精矿R(Al2O3、Fe2O3)粉末48.8g加入含1mol NaOH的溶液中,发生的反应为:
Al2O3(s)+2NaOH(aq)+ 2H2O(l)→2NaAl(OH)4(aq)
充分反应后,过滤、洗涤、干燥,得到8.0g固体,则该精矿Al2O3的质量分数为 (精确到0.001)。
往滤液中通入CO2,发生的反应为:2NaAl(OH)4 + CO2→2Al(OH)3↓+ Na2CO3+ H2O
若生成0.5 mol Na2CO3,则生成Al(OH)3 mol。
52.2.有反应Al2O3(s)+ Na2CO3(s) 2NaAlO2(s)+ CO2(g)
2NaAlO2(s)+ CO2(g)
2NaAlO2(aq)+ CO2(g) +3H2O→2Al(OH)3↓+ Na2CO3
若以铝土精矿R和Na2CO3为原料,除得到Al2O3外,还得到“赤泥”,其成分为(金属元素均以氧化物形式表示):
Al2O3 | Fe2O3 | Na2O | |
质量分数 | 0.065 | 0.850 | 0.029 |
每1t铝土精矿生产时:
得到的赤泥 t(精确到0.001,下同);
可制得Al2O3得 t;
需要补充购买Na2CO3 kg。
53.3.取a g Al2O3加入溶质的质量分数为b的硫酸溶液中,充分反应后再往溶液加入一定量的(NH4)2SO4,加热、搅拌,冷却后全部溶液正好转化为45.3 g铝铵矾晶体[NH4Al(SO4)2·12H2O,式量:453],则a= ;b= (精确到0.001).
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖南省益阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
下列推断合理的是
A.在常温下,Na2SiO3+H2O+CO2=Na2CO3+H2SiO3↓,说明H2CO3酸性强于H2SiO3;在高温下,Na2CO3+SiO2= Na2SiO3+CO2↑,说明H2SiO3酸性强于H2CO3;
B.胶体区别于其他分散系的本质特点是能产生丁达尔现象
C.KAl(SO4)2·12H2O是复盐;(NH4)2Fe(SO4)2也是复盐
D.CaCl2、NaOH、HCl、HD四种物质都属于化合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com