
某同学用下图所示的装置及药品进行比较酸性强弱的实验,一段时间后试管②中有胶冻状物质生成。下列说法正确的是
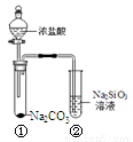
A.向Na2SiO3溶液中滴入酚酞溶液无明显现象
B.试管①中反应的离子方程式是:Na2CO3+ 2H+ == 2Na+ + CO2↑+ H2O
C.该实验可以证明酸性:盐酸>碳酸>硅酸
D.若将盐酸换成硫酸,能证明酸性:硫酸>碳酸>硅酸
 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源:2014-2015福建省龙岩市非一级达标校高一上学期期末化学试卷(解析版) 题型:选择题
下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是
A | B | C | D | |
试样 | NaCl溶液(Na2CO3) | NaCl固体(I2) | CO2(SO2) | NaHCO3溶液(Na2CO3) |
除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 加热 |
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列实验中,所选试剂与装置均合理的是

A.用饱和食盐水除去氯气中的氯化氢,选①
B.分离溶液和胶体,选②
C.用自来水制取蒸馏水,选③
D.用酒精提取碘水中的碘,选④
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市丰台区高一上学期期末考试化学试卷(解析版) 题型:选择题
在“空气质量日报”中,不被列入首要污染物的是
A.二氧化硫 B.氮氧化物 C.可吸入颗粒物 D.二氧化碳
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:填空题
H2O2是重要的化工原料。
(1)H2O2中O元素的化合价为______。
(2)①向酸性KMnO4溶液中滴加H2O2溶液,溶液褪色,体现了H2O2的还原性,其中氧化过程是:H2O2→______(填化学式)。
②向H2SO4酸化的FeSO4溶液中滴加H2O2溶液,溶液变成黄色,体现了H2O2的氧化性,反应的离子方程式是_________。
(3)H2O2不稳定易分解。实验室需要448 mL O2(标准状况),则理论上最少需要用30%的H2O2溶液(密度为1.10 g/mL)_______mL。(计算结果保留一位小数)
查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
用NaOH固体配制一定物质的量浓度的溶液200 mL,需经过称量、溶解、转移、定容等操作。下列图示对应的操作规范的是

查看答案和解析>>
科目:高中化学 来源:2014-2015北京市朝阳区高一上学期期末考试化学试卷(解析版) 题型:选择题
下列关于NaCl的说法不正确的是
A.给NaCl溶液通电,使NaCl发生电离
B.NaCl是电解质
C.NaCl电离的方程式是:NaCl== Na+ +Cl
D.NaCl溶液能导电,是因为溶液中有自由移动的离子
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省高三上学期期中考试化学试卷(解析版) 题型:填空题
硫元素有多种化合价,可形成多种化合物。
(1)常温下用1 molL-1 100 mL NaOH溶液恰好完全吸收0.1 mol SO2气体,此反应的离子方程式为 ;该溶液pH<7的原因是 (结合方程式回答)。以石墨作电极,电解该物质的饱和溶液时,只有一个电极产生气体,写出阳极的电极反应式 。
(2)请按照浓度由大到小的顺序排列0.1mol/LNa2SO3溶液中的离子 。Na2SO3溶液放置于空气中一段时间后,溶液的pH (填“增大”“减小”或“不变”)。
(3)某同学在常温下设计如下实验流程探究Na2S2O3的化学性质。

实验①可说明 (填字母)
A.该Na2S2O3溶液中水电离的c(OH—)=10—8mol/L
B.H2S2O3是一种弱酸
C.Na2S2O3是一种弱电解质
D.Na2S2O3水解方程式为S2O32—+2H2O H2S2O3+2OH—
H2S2O3+2OH—
写出实验②发生反应的离子方程式 。
(4)实验室制得的Na2S2O3粗晶体中往往含有少量杂质。为了测定粗产品中Na2S2O3·5H2O的含量,一般采用在酸性条件下用KMnO4标准液滴定的方法(假定粗产品中杂质与酸性KMnO4溶液不反应)。
称取1.28 g的粗样品溶于水,用0.40 mol/L KMnO4溶液(加入适量硫酸酸化)滴定,当溶液中S2O32—全部被氧化时,消耗KMnO4溶液体积20.00 mL。
(5S2O32—+8MnO4—+14H+ =8Mn2++10SO42—+7H2O) 。试回答:
①此滴定实验是否需要指示剂 (填“是”或“否”),KMnO4溶液置于 (填“酸式”或“碱式”)滴定管中。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则会使样品中Na2S2O3·5H2O的质量分数的测量结果会 (填“偏高”“偏低”或“不变”)。
③产品中Na2S2O3·5H2O的质量分数为 。(Na2S2O3·5H2O式量:248)(保留小数点后两位数)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年上海市静安区高三上学期期末教学质量检测化学试卷(解析版) 题型:选择题
某稀土元素R的精矿样品中,R的氧化物的质量分数为0.8515。20.2g该样品与100 mL 1mol/L稀硫酸恰好完全反应(杂质不反应),生成ROSO4和H2O,则R的相对原子质量约为
A.78 B.140 C.156 D.172
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com