
����Ŀ��ijС������H2C2O4��Һ�������ữ��KMnO4��Һ��Ӧ��̽������������Ի�ѧ��Ӧ���ʵ�Ӱ�족��ʵ��ʱͨ���ⶨ����KMnO4��Һ��ɫ����ʱ�����жϷ�Ӧ�Ŀ�������С����������·�������֪��KMnO4��H2C2O4��H2SO4��K2SO4��MnSO4��CO2����H2O ��δ��ƽ����
0.1mol��L��1KMnO4������Һ�����/mL | 0. 6mol��L��1 H2C2O4��Һ�����/mL | H2O�Ļ�/mL | ʵ���¶�/�� | ��Һ��ɫʱ����ʱ��/min | |
ʵ��1 | 10 | V1 | 35 | 25 | |
ʵ��2 | 10 | 10 | 30 | 25 | |
ʵ��3 | 10 | 10 | V2 | 50 |
(1)����V1=___________mL , V2=___________mL��
(2)̽���¶ȶԻ�ѧ��Ӧ����Ӱ���ʵ������________(���ţ���ͬ)����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ���ʵ������____________��
(3)ʵ��ٲ��KMnO4��Һ����ɫʱ��Ϊ2 min�����Ի��ǰ����Һ�����С�仯�����ʱ����ƽ����Ӧ����v(H2C2O4)��________________��
(4)��֪50 ��ʱc(MnO![]() )����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO
)����Ӧʱ��t�ı仯������ͼ�������������������䣬��������ͼ�У�����25 ��ʱc(MnO![]() )��t�ı仯����ʾ��ͼ________��
)��t�ı仯����ʾ��ͼ________��

���𰸡� 5 30 2��3 1��2 0.025 mol��L��1��min��1 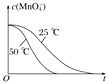
��������(1)�ɱ���ʵ��2��ʵ��1֪���¶���ͬ��������Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�졣������Һ�������ҲӦ����ͬ��Ϊ50mL,����֪������V1��Һ���Ϊ60-35-10=5mL ,V2=50-10-10=30mL��
(2)�����ϱ�����ʵ��2��ʵ��3��Ӧ��Ũ����ͬ���¶Ȳ�ͬ��������̽���¶ȶԻ�ѧ��Ӧ���ʵ�Ӱ������أ���ʵ������ 2��3�������ϱ�����ʵ��2��ʵ��1��Ӧ���¶���ͬ��Ũ�Ȳ�ͬ.����̽����Ӧ��Ũ�ȶԻ�ѧ��Ӧ����Ӱ��ģ���ʵ����Ӧ����1��2��
(3)�ɻ�ѧ��Ӧ��ϵ��֪��2KMnO4 ��5H2C2O4��3H2SO4=K2SO4��2MnSO4��10CO2����8H2O����� KMnO4 �����ʵ���Ϊ0.01![]() 0.1=0.001mol, �����H2C2O4 �����ʵ���Ϊ0.005
0.1=0.001mol, �����H2C2O4 �����ʵ���Ϊ0.005![]() 0.6=0.003mol, 2KMnO4
0.6=0.003mol, 2KMnO4 ![]() 5H2C2O4��ϵ֪��H2C2O4���������Բμӷ�Ӧ��n(H2C2O4)= 0.01
5H2C2O4��ϵ֪��H2C2O4���������Բμӷ�Ӧ��n(H2C2O4)= 0.01![]() 0.1
0.1![]() 5/2=0.0025mol
5/2=0.0025mol
ʵ�������KMnO4��Һ����ɫʱ��Ϊ2 min������H2C2O4��2 min��ƽ����Ӧ����v(H2C2O4)��0.0025mol/(0.05L![]() 2 min)= 0.025 mol��L��1��min��1���𰸣�0.025 mol��L��1��min��1
2 min)= 0.025 mol��L��1��min��1���𰸣�0.025 mol��L��1��min��1
(4)����Ӱ�컯ѧ��Ӧ���ʵ����ؿ�֪�������¶Ȼ�ѧ��Ӧ���ʼӿ죬��֪50 ��ʱc(MnO![]() )����Ӧʱ��t�ı仯������ͼ�������������������䣬25 ��ʱ��ѧ��Ӧ���ʼ���������ʱ��䳤������c(MnO
)����Ӧʱ��t�ı仯������ͼ�������������������䣬25 ��ʱ��ѧ��Ӧ���ʼ���������ʱ��䳤������c(MnO![]() )��t�ı仯����ʾ��ͼΪ
)��t�ı仯����ʾ��ͼΪ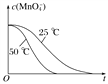 ��
��


 ѧ���쳵��������������������ϵ�д�
ѧ���쳵��������������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A.������ˮ��Һ�ܵ��磬���������ǵ����
B.�����ܵ���˵�������ǵ����
C.�ƾ���ˮ��Һ�к�����״̬�¶������磬�ƾ��Ƿǵ����
D.NaCl��H2SO4���ǵ���ʣ�����������״̬��һ���ܵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤��������ֵ������������ȷ���ǣ�������
A.0.1 molL��1������Һ�к��д�����ӵ���ĿΪ0.1NA
B.25��ʱ��1 L pH=12��Na2CO3��Һ�к���Na+����ĿΪ0.2 NA
C.�����£�20 L pH=12��Na2CO3��Һ�к���OH����ĿΪ0.2 NA
D.ij�ܱ�����ʢ��0.1 mol N2��0.3 mol H2 �� ��һ�������³�ַ�Ӧ��ת�Ƶ�����ĿΪ0.6 NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20.0g NaOH��ϡ��Һ��ϡ������ȫ��Ӧʱ���ų�28.7kJ����������ʾ�÷�Ӧ���Ȼ�ѧ����ʽ��ȷ���ǣ�������
A.NaOH��aq��+HNO3��aq��=NaNO3��aq��+H2O��l����H=+28.7kJmol��1
B.NaOH+HNO3=NaNO3+H2O��H=��28.7kJmol��1
C.NaOH��aq��+HNO3��aq��=NaNO3��aq��+H2O��l����H=��57.4kJmol��1
D.NaOH��aq��+HNO3 ��aq��=NaNO3 ��aq��+H2O��l����H=��57.4 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Ag2O�����һ�ֿ�����ˮ�¶�����������Դ����ԭ����ͼ��ʾ���õ�ع���ʱ�ܷ�ӦʽΪ2Al��3Ag2O��2NaOH=2NaAlO2��6Ag��H2O��������˵��������� (����)��
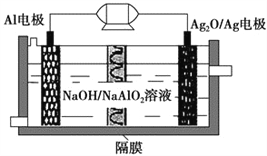
A. ����ʱ����������ԭ��Ӧ��������������С
B. ���缫������1.08 g Agʱ����·��ת�Ƶĵ���Ϊ0.1 mol
C. Al�缫�ķ�ӦʽΪAl��3e����4OH��=AlO2����2H2O
D. ����ʱ���Һ�е�Na������Ag2O/Ag�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ʵ��ǣ� ��
A. ˮ B. ������ C. ������ D. ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ش��������⣺ I���������ʵ�����A��B��Ϸ���2L���ܱ������У�������Ӧ3A��g��+B��g��xC��g��+2D��g������5min��ﵽƽ�⣬ƽ��ʱ���D��Ũ��Ϊ0.5mol/L��c��A����c��B��=3��5��v��C��=0.1mol/��Lmin������
��1��x= ��
��2��ǰ5min��B�ķ�Ӧ����v��B��= ��
��3��ƽ��ʱA��ת����Ϊ ��
��4��II��ˮ����ͨ�����ȵ�̼�㷢����Ӧ��C��s��+H2O��g��CO��g��+H2��g����H�� ��֪��K��300�棩��K��350�棩����÷�Ӧ���ȷ�Ӧ��
��5��������Ӧ��t0ʱ�̴ﵽƽ�⣬��t1ʱ�̸ı�ijһ����������Ӧ���ʣ���������ʱ��ı仯����ͼ��ʾ�������Ӧ�ı�ţ� 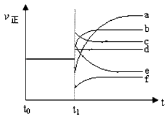
����С��������� �ڽ����¶�
��6����֪��Ӧ��CO��g��+CuO��g��CO2��g��+Cu��s����H2��g��+CuO��g��Cu��s��+H2O��g�� ����ͬ��ij�¶��µ�ƽ�ⳣ���ֱ�ΪK1��K2 �� ���¶��·�ӦCO��g��+H2O��g��CO2��g��+H2��g����ƽ�ⳣ��K=����K1��K2��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й���ϩ��˵������ȷ���ǣ�������
A.��ϩʹ��ˮ�����Ը��������Һ��ɫԭ����ͬ
B.��ϩ����������ԭ�Ӷ���ͬһ��ƽ���ϣ���̼���֮��ļ���ԼΪ 120��
C.��ȥ���������е���ϩ���Խ��������ͨ��ʢ���������Ը��������Һ��ϴ��ƿ
D.��ϩ�ͻ����飨 ![]() ���ķ�����ɷ���ͨʽ CnH2n �� �����������ͬϵ��
���ķ�����ɷ���ͨʽ CnH2n �� �����������ͬϵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ������ȷ����
A. ������������Һ��ȥ�����������Ĥ:Al2O3+2OH-==2A1O2-+ H2O
B. С�մ���������θ�����:CO32-+2H+==CO2��+H2O
C. ��ɫ��AgI����Һ�м���Na2S��Һ���ڣ�2Ag++S2-=Ag2S ��
D. �ö��Ե缫��������Ȼ���:2Cl-+2H2O![]() Cl2��+H2��+2OH-
Cl2��+H2��+2OH-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com