
【题目】下列属于生物大分子物质的是( )
A. 水 B. 蛋白质 C. 葡萄糖 D. 无机盐
科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学反应方程式为: CO(g)+2H2(g)CH3OH(g)△H<0按照相同的物质的量投料,测的CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是( )
A.平衡常数:K(a)>K(c),K(b)=K(d)
B.正反应速率:v(a)>v(c),v(b)>v(d)
C.平均摩尔质量:M(a)<M(c),M(b)>M(d)
D.平衡时a点一定有n(CO):n(H2)=1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁是常见的水处理剂,工业上制备无水FeCl3的一种工艺如下: 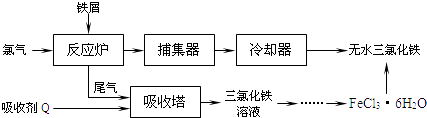
(1)试写出吸收塔中反应的离子方程式: .
(2)六水合氯化铁在水中的溶解度如下:
温度/℃ | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH2O) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液制得FeCl36H2O晶体的操作步骤是:加入少量盐酸、、、过滤、洗涤、干燥.
(3)常温下,若溶液的pH控制不当会使Fe3+沉淀,pH=4时,溶液中c(Fe3+)=molL﹣1 . (常温下Ksp[Fe(OH)3]=2.6×10﹣39).
(4)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,滴入某一指示剂并用c molL﹣1 Na2S2O3溶液滴定用去V mL.(已知:I2+2S2O32﹣═2I﹣+S4O62﹣) ①滴定终点的现象是: .
②求样品中氯化铁的质量分数(写出计算过程) .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,m、n、p、q依次为四种元素的单质;r、t、u 为二元化合物,其中u 是我国北方主要的大气污染物之一,可使品红溶液褪色;25℃,0.01mo/L的v溶液pH=12;上述物质间转化关系如图,下列说法错误的是
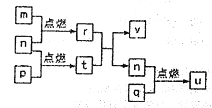
A. Y、Z、W的简单离子半径:W>Y>Z
B. W、Y 分别与X形成的简单化合物的沸点: Y>W
C. X和Y、Z和Y都能形成不止一种二元化合物
D. X、Y、Z、W 中任意三种元素形成的化合物都抑制水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组利用H2C2O4溶液和硫酸酸化的KMnO4溶液反应来探究“外界条件对化学反应速率的影响”。实验时通过测定酸性KMnO4溶液褪色所需时间来判断反应的快慢。该小组设计了如下方案。已知:KMnO4+H2C2O4+H2SO4→K2SO4+MnSO4+CO2↑+H2O (未配平)。
0.1mol·L-1KMnO4酸性溶液的体积/mL | 0. 6mol·L-1 H2C2O4溶液的体积/mL | H2O的积/mL | 实验温度/℃ | 溶液褪色时所需时间/min | |
实验1 | 10 | V1 | 35 | 25 | |
实验2 | 10 | 10 | 30 | 25 | |
实验3 | 10 | 10 | V2 | 50 |
(1)表中V1=___________mL , V2=___________mL。
(2)探究温度对化学反应速率影响的实验编号是________(填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是____________。
(3)实验①测得KMnO4溶液的褪色时间为2 min,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(H2C2O4)=________________。
(4)已知50 ℃时c(MnO![]() )~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO
)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25 ℃时c(MnO![]() )~t的变化曲线示意图________。
)~t的变化曲线示意图________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
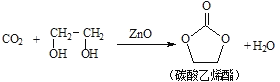
回答下列问题:
(1)锌基态离子的价电子排布图为_______________;在基态18O原子中,核外电子存在_________种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol 碳酸乙烯酯中含有的σ键的数目为__________NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________(填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示(乙装置中X为阳离子交换膜,甲醚的结构简式为CH3OCH3) 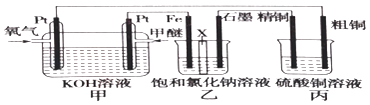
根据要求回答下列相关问题:
(1)写出负极的电极反应: .
(2)氢氧化钠主要在(填“铁极”或“石墨极”)区生成.
(3)如果粗铜中含有锌、银等杂质,则粗铜的电极反应为:、 .
(4)反应一段时间,硫酸铜溶液的浓度将(填“增大”、“减小”或“不变”).
(5)若在标准状况下有2.24L氧气参加反应,丙装置中阴极析出铜的质量为 .
(6)若将丙装置改成在标准状况下,用石墨作电极电解体积为2L的CuSO4溶液,写出电解CuSO4溶液时的离子反应方程式;当电解适当时间后断开电源,发现只需补充22.2g固体Cu2(OH)2CO3即可使电解液恢复到原浓度与体积,则原CuSO4溶液的浓度是mol/L;若将丙设计成在镀件上镀铜的装置,该如何改动,请用简要的语言叙述: .
(7)若将乙中的交换膜去掉,发现只有H2逸出,则试写出乙池中发生的总反应: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一真空固定体积的密闭容器中,充入10mol N2和30mol H2混合后发生反应:N2+3H22NH3 . 在一定温度下达到平衡,H2的转化率为20%.若在同一容器中充入NH3 , 欲使反应达到平衡时各成分的百分含量与上述平衡时相同,则起始时充入NH3的物质的量和达到平衡时NH3的转化率是( )
A.15mol 20%
B.20mol 20%
C.20mol 80%
D.40mol 80%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com