
【题目】二氧化碳和乙二醇在氧化锌或锌盐催化下可合成碳酸乙烯酯。
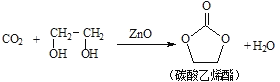
回答下列问题:
(1)锌基态离子的价电子排布图为_______________;在基态18O原子中,核外电子存在_________种空间运动状态。
(2)乙二醇中C、H、O的电负性大小关系是__________ ;碳酸乙烯酯中碳原子的杂化轨道类型有___________;1mol 碳酸乙烯酯中含有的σ键的数目为__________NA。
(3)锌盐水溶液中Zn2+可与H2O之间形成[Zn(H2O)6]2+,配体中的配位原子是_________(填微粒符号),[Zn(H2O)6]2+中所含化学键的类型为__________________________。
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为______________。
(5)一种锌金合金晶体的立方体晶胞中,金原子位于顶点,锌原子位于面心,则该合金中金原子与锌原子的个数之比为_________;若该晶体的晶胞棱长为apm(1pm=10-12m),则该合金的密度为_______g·cm-3(用NA表示阿伏加德罗常数的值,列出算式不要求结果)。
【答案】 ![]() 5 O>C>H sp2、sp3 10 O 配位键、共价键 HF2- 1:3 【答题空10】
5 O>C>H sp2、sp3 10 O 配位键、共价键 HF2- 1:3 【答题空10】![]()
【解析】(1)锌为30号元素,锌基态离子的价电子排布式为3d10,电子排布图为![]() ;在基态18O原子核外有8个电子,电子排布式为1s22s22p4,存在1s、2s、2px、2py、2pz,5种空间运动状态,故答案为:
;在基态18O原子核外有8个电子,电子排布式为1s22s22p4,存在1s、2s、2px、2py、2pz,5种空间运动状态,故答案为:![]() ;5;
;5;
(2)元素的非金属性越强,电负性数值越大, C、H、O的电负性大小关系为O>C>H;碳酸乙烯酯(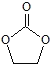 )中有2种碳原子,其中碳氧双键中的碳原子采用sp2杂化,亚甲基中的碳原子采用sp3杂化;1mol碳酸乙烯酯中含有的σ键有:1molC=O,4molC-O,4molC-H,1molC-C,共10molσ键,数目为10NA,故答案为:O>C>H;sp2、sp3;10;
)中有2种碳原子,其中碳氧双键中的碳原子采用sp2杂化,亚甲基中的碳原子采用sp3杂化;1mol碳酸乙烯酯中含有的σ键有:1molC=O,4molC-O,4molC-H,1molC-C,共10molσ键,数目为10NA,故答案为:O>C>H;sp2、sp3;10;
(3)Zn2+含有空轨道,配体H2O含有孤电子对,其中O原子提供孤电子对为配位原子;配离子[Zn(H2O)6]2+中含有配位键、共价键,故答案为:O;配位键、共价键;
(4)阴离子X-与CO2互为等电子体且X-内含共价键和氢键,则X-的化学式为 HF2-,故答案为:HF2-;
(5)在晶胞中,Au原子位于顶点,Zn原子位于面心,该晶胞中Au原子个数=8×![]() =1,Zn原子个数=6×
=1,Zn原子个数=6×![]() =3,所以该合金中Au原子与Zn原子个数之比=1:3,
=3,所以该合金中Au原子与Zn原子个数之比=1:3,
晶胞体积V=(a×10-10cm)3,每个晶胞中锌原子个数是3、Au原子个数是1,则ρ=![]() =
=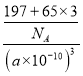 =
=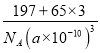 g/cm3,故答案为:1:3;
g/cm3,故答案为:1:3;  。
。


科目:高中化学 来源: 题型:
【题目】某混合气体由一种气态烷烃和一种气态烯烃组成,在同温同压下,混合气体对氢气的相对密度为13,在标准状况下,将56.0L混合气体通入足量溴水,溴水质量增重35.0g,则这两种烃分别是( )
A. CH4 C5H12 B. C2H6 C4H8 C. CH4 C4H8 D. C2H2 C4H10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业中,每生产2molNH3 , 放出92.4kJ热量.
(1)写出合成氨反应的热化学方程式为 .
(2)已知: 
1mol N﹣H键断裂吸收的能量等于kJ.
(3)已知关于铁的氧化物存在下列三个热化学方程式: Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=﹣24.8kJ/mol ①
Fe2O3(s)+ ![]() CO(g)═
CO(g)═ ![]() Fe3O4(s)+
Fe3O4(s)+ ![]() CO2(g)△H=﹣15.73kJ/mol ②
CO2(g)△H=﹣15.73kJ/mol ②
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.4kJ/mol ③
则CO还原FeO的热化学方程式为CO(g)+FeO(s)═Fe(s)+CO2(g)△H=kJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物G(1,6-己二酸)是合成尼龙的主要原料之一,可由烃A制备,合成路线如图1,烃A的质谱图如图2,回答下列问题:


(1)A的化学名称为________,D的官能团名称为__________________。
(2)A→B的反应类型是______________,F→G的反应类型是_______________。
(3)F的结构简式为___________________________。
(4)若H2NRNH2为已二胺,则由G合成尼龙的反应方程式为_____________________________。与G含有相同官能团的同分异构体共有__________种,其中核磁共振氢谱为4组峰,且峰面积比为1∶1∶2∶6的结构简式是______________(写出一种即可)。
(5)由A通过两步反应制备1,3-环己二烯的合成路线为______________________。(其它试剂任选)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知正四面体形分子E和直线型分子G反应,生成四面体形分子L和直线型分子M.(组成E分子的元素的原子序数小于10,组成G分子的元素为第三周期的元素.)如图,则下列判断中正确的是( ) 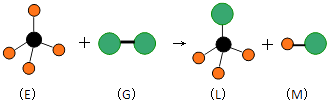
A.常温常压下,L是一种液态有机物
B.E是一种含有非极性键的分子
C.干燥的G 能漂白有色物质
D.上述反应的类型是取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于各图的说法,正确的是( ) 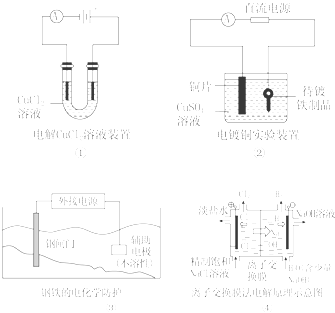
A.①中阴极处能产生使湿润淀粉KI试纸变蓝的气体
B.②中待镀铁制品应与电源正极相连
C.③中钢闸门应与外接电源的正极相连
D.④中的离子交换膜可以避免生成的Cl2与NaOH溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外小组分别用如图所示装置对原电池和电解原理进行实验探究. 请回答:
Ⅰ.用图 1 所示装置进行第一组实验.
(1)在保证电极反应不变的情况下,不能替代 Cu 作电极的是(填字母序号).
(2)N 极发生反应的电极反应式为 . Ⅱ.用图 2 所示装置进行第二组实验.实验过程中,观察到与第一组实验不同的现象:两极 均有气体产生,Y 极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清. 查阅资料得知,高铁酸根离子(FeO42﹣)在溶液中呈紫红色.
(3)电解过程中,X 极区溶液的 pH(填“增大”“减小”或“不变”).
(4)电解过程中,Y 极发生的电极反应之一为 Fe﹣6e﹣+8OH﹣═Fe4O2﹣+4H2O 若在 X 极收集到672mL 气体,在 Y 极收集到 168mL 气体(均已折算为标准状况时气体体积),则 Y 电极(铁 电极)质量减少g.
(5)在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为 2K2FeO4+3Zn═Fe2O3+ZnO+2K2ZnO2 . 该电池正极发生的反应的电极反应式为 . 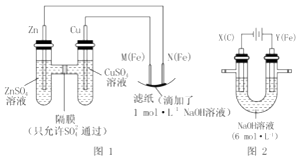
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com