
【题目】硼(B)钴(Co)和锰(Mn)形成物质时比较复杂和变化多端。
(1) Co基态原子核外电子排布式为_________,第二周期元素第一电离能比B高的有______种;
(2)硝酸锰是工业制备中常用的催化剂,Mn(NO3)2中的化学键除了σ键外,还存在______;
(3)NaBO2可用于织物漂白。BO2-的空间构型为_______写出两种与其互为等电子体的分子的化学式:_______;
(4)下图表示偏硼酸根的一种无限长的链式结构,其化学式可表示为____(以n表示硼原子的个数);

下图表示的是一种五硼酸根离子, 其中B原子的杂化方式为________;

(5)立方BN和立方AIN均为原子晶体,结构相似,BN的熔点高于AIN的原因为_______________;
(6)一种新型轻质储氢材料的晶胞结构如下图所示,设阿伏加德罗常数的值为NA,该晶体的密度为__gcm-3(用含a、NA的代数式表示)。

【答案】1s22s22p63s23p63d74s2或[Ar]3d74s2 6 π键、离子键 直线形 CO2或CS2或N2O或BeCl2 (BO2)nn- sp3、sp2 B原子半径更小,B-N键键长更短,键能更大 ![]()
【解析】
(1) Co 为27号元素,根据构造理论书写排布式;B位于周期表中第2周期,第ⅢA族,同周期主族元素,随着原子序数的增大,第一电离能有增大的趋势,但第ⅡA族和第ⅤA族元素反常;
(2)硝酸锰是离子化合物,硝酸根中3个氧原子和中心原子N之间形成一个4中心6电子的大π键;
(3) BO2-的中心原子的价层电子对数为2,孤电子对数为0;原子总数相等、价电子总数也相等的微粒互为等电子体;
(4) 根据均摊思想分析偏硼酸根离子的化学式,根据杂化轨道理论判断五硼酸根离子中B原子的杂化方式;
(5)原子半径越小,键长越短,键能越大,原子晶体的熔点越高;
(6)结合晶胞中各离子数目计算晶胞质量,晶体密度=晶胞质量÷晶胞体积。
(1) Co为27号元素,根据构造理论,其基态原子核外电子排布式为1s22s22p63s23p63d74s2或[Ar]3d74s2;同周期主族元素,随着原子序数的增大,随着原子序数的增大,第一电离能有增大的趋势,但第ⅡA族和第ⅤA族元素反常,所以第一电离能比B大的有Be,C,N,O,F,Ne,共有6个元素;
(2)硝酸锰是离子化合物,硝酸根和锰离子之间形成离子键,硝酸根中3个氧原子和中心原子N之间形成一个4中心6电子的大π键,所以除σ键外,还存在π键和离子键;
(3)BO2的中心原子的价层电子对数为2,孤电子对数为0,立体构型为直线形;与BO2由3个原子构成,价层电子数为16,互为等电子体的分子有CO2、CS2、N2O、BeCl2等;
(4)根据均摊思想,无限长链式偏硼酸根离子中,一个B相当于占有O的数目为1+2×![]() =2,所以其化学式可表示为:(BO2)n n;根据杂化轨道理论,五硼酸根离子中,B原子部分形成3根共价键,为sp2杂化,部分形成4根共价键,为sp3杂化;
=2,所以其化学式可表示为:(BO2)n n;根据杂化轨道理论,五硼酸根离子中,B原子部分形成3根共价键,为sp2杂化,部分形成4根共价键,为sp3杂化;
(5)立方BN和立方AlN均为原子晶体,B原子半径更小,BN键键长更短,键能更大,熔点更高;
(6)晶胞中,Na+位于晶胞的面上和棱上,离子数目=4×![]() +4×
+4×![]() =3;Li+位于晶胞的面心,离子数目=2×
=3;Li+位于晶胞的面心,离子数目=2×![]() =1,BH4位于顶点、面心和体心离子数目=1+4×
=1,BH4位于顶点、面心和体心离子数目=1+4×![]() +8×
+8×![]() =4,故该物质的化学式为Na3Li(BH4)4,晶胞的体积V=(a×1010cm)2×(2a×1010cm),晶胞质量=
=4,故该物质的化学式为Na3Li(BH4)4,晶胞的体积V=(a×1010cm)2×(2a×1010cm),晶胞质量=![]() g,晶体密度=
g,晶体密度=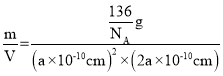 =
=![]() gcm3。
gcm3。


科目:高中化学 来源: 题型:
【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
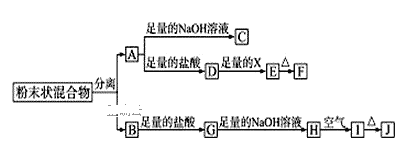
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
I.研究小组用炼铁厂的铁矾渣制备FeCO3,铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。
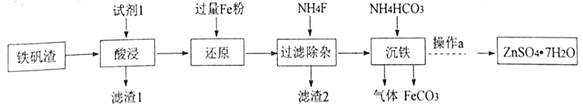
(1)试剂1是过量的_______,滤渣 2的成分是__________ (写化学式);
(2)“沉铁”发生反应的离子方程式是____________;
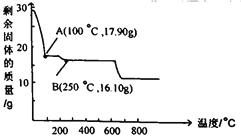
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是__,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100°C时所得固体的化学式____。
II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。
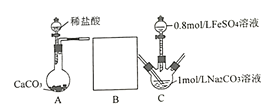
(1)画出装置B______________,B中所用试剂为______________;
(2)先向1mol/L Na2CO3溶液中通入CO2的目的是_________________________;
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是_______________(不考虑操作不当引起的误差)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清溶液中可能含有Na+、K+、NH4+、Mg2+、Fe2+、SO42﹣、SO32﹣、Cl﹣、I﹣、CO32﹣中的若干种,且离子浓度都相等。现取该溶液进行有关实验,实验结果如下图所示:
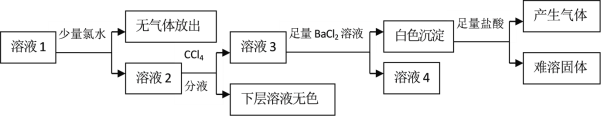
下列关于该溶液的说法中正确的是
A.通过CCl4层无色可以推知原溶液中一定不存在I-
B.向白色沉淀中加入盐酸产生气体并留有难溶固体可推知原溶液中存在SO32﹣和CO32-
C.该溶液中不可能同时存在NH4+和Cl-
D.另取该溶液加入足量浓NaOH溶液,加热,若试管口的湿润红色石蕊试纸不变蓝,则可确定原溶液中所有离子的存在情况
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
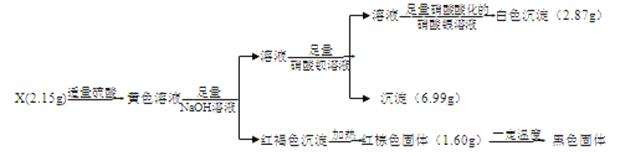
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
①该原子的相对原子质量为![]() ②m g该原子的物质的量为
②m g该原子的物质的量为![]() mol ③该原子的摩尔质量是a NA g ④W g该原子中含有
mol ③该原子的摩尔质量是a NA g ④W g该原子中含有![]() 个该原子⑤由已知信息可得:NA=
个该原子⑤由已知信息可得:NA=![]()
A.①③⑤B.②③④C.①②⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为24。
(1)W基态原子的核外电子排布式为___________,元素X、Y、Z的第一电离能由大到小的顺序为___________(用元素符号表达);
(2)与XYZ-互为等电子体的化学式为___________;
(3)1molHYZ3分子中含有σ键的数目为___________;
(4)YH3极易溶于水的主要原因是___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com