
����Ŀ��I��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1��X������ˮ��������ǿ�ᡣij�о�С��Ϊ̽������ɺ����ʣ���Ʋ����������ʵ�顣
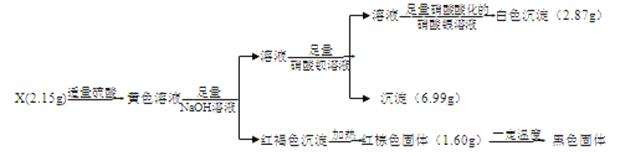
��1��X�Ļ�ѧʽ��____________________��
��2��д�������ɫ��Һ�н��������ӵ�ʵ�������__________��
��3����ɫ��Һ�м���ͭƬ��ͭƬ���汻��ʴ�����Ӧ�����ӷ���ʽ�ǣ�_____________________��
II����֪��ɫ�����в������ʡ�Ϊ��һ��̽������ɣ��о�С�齫�������ù���ȫ������ϡ���ᣬ���100mL��Һ��ÿ��ȡ20.00mL����Һ����ƿ�У���2.000��10-2molL-1 KMnO4����Һ���еζ�������¼ʵ��Ľ�����±���
��� | 1 | 2 | 3 | 4 |
V����mL�� | 20.00 | 20.02 | 19.99 | 19.99 |
��4������жϵζ��յ㣺__________________��
��5������Һ��c(Fe2+) = ____________________��
��6���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ�ɱ�ʾΪ_______________��
���𰸡�FeOCl ȡ������ɫ��Һ���ڽྻ�Թ��У��μӼ���KSCN��Һ������Һ��Ѫ��ɫ����˵����Fe3+ 2Fe3+ + Cu = 2Fe2+ + Cu2+ �����һ�α�KMnO4��Һ������ƿʱ����Һǡ�ñ�dz�ϣ��죩ɫ���Ұ�����ڲ���ɫ 0.1000mol.L-1 Fe4O5
��������
I��������������Ϣ��֪��2.15gX���������ᷴӦ�õ���ɫ��ҺΪ���������Ӽ���������ӵȵ���Һ����ɫ��Һ����������������Һ�������ɺ��ɫ�����������������������������Ⱥ����ɺ���ɫ����1.60g����������![]() =0.01mol����X�к���0.02 molFe3+������Ϊ0.02 mol
=0.01mol����X�к���0.02 molFe3+������Ϊ0.02 mol![]() =1.12g������������������Һ��Ӧ����Һ�����������ᱵ��Һ��Ӧ�������ᱵ����6.99g����Ϊ
=1.12g������������������Һ��Ӧ����Һ�����������ᱵ��Һ��Ӧ�������ᱵ����6.99g����Ϊ![]() =0.03mol��������������������������ᣬ��Ӧ������Һ���������������ữ����������Һ��Ӧ�õ���ɫ�����Ȼ���2.87g����Ϊ
=0.03mol��������������������������ᣬ��Ӧ������Һ���������������ữ����������Һ��Ӧ�õ���ɫ�����Ȼ���2.87g����Ϊ![]() =0.02mol���ʿ���֪X�к���0.02molCl-������Ϊ0.02 mol
=0.02mol���ʿ���֪X�к���0.02molCl-������Ϊ0.02 mol![]() =0.71g��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1������һ�ǽ���Ԫ��ҲΪ0.02 mol��������Ϊ2.15g-1.12g-0.71g=0.32g����Ħ������Ϊ
=0.71g��������X��������Ԫ�أ���������Ϊ�ǽ���Ԫ�أ���ԭ�Ӹ�����Ϊ1:1������һ�ǽ���Ԫ��ҲΪ0.02 mol��������Ϊ2.15g-1.12g-0.71g=0.32g����Ħ������Ϊ![]() =16g/mol��ӦΪOԪ�أ���XΪFeOCl��
=16g/mol��ӦΪOԪ�أ���XΪFeOCl��
��1��X�Ļ�ѧʽ��FeOCl��
��2�������ɫ��Һ�н���������Fe3+��ʵ�����Ϊ��ȡ������ɫ��Һ���ڽྻ�Թ��У��μӼ���KSCN��Һ������Һ��Ѫ��ɫ����˵����Fe3+��
��3����ɫ��Һ�м���ͭƬ��ͭƬ���汻��ʴ����Ӧ����Fe2+��Cu2+����Ӧ�����ӷ���ʽ�ǣ�2Fe3+ + Cu= 2Fe2+ + Cu2+��
II����4����ɫ�������������������Һ�к����������ӣ������Ը��������Һʹ����ɫ�����жϵζ��յ�Ϊ�������һ�α�KMnO4��Һ������ƿʱ����Һǡ�ñ�dz�ϣ��죩ɫ���Ұ�����ڲ���ɫ��
��5�����ݱ������ݿ�֪���ζ����ĵı�Һ��ƽ�����Ϊ20.00mL�����ݷ�Ӧ5Fe2+ + MnO4-+ 8H+=5Fe3+ + Mn2+ +4H2O��֪������Һ��c(Fe2+) =![]() ��
��
��6����ɫ�����к��е�Fe2+���ʵ���Ϊ![]() ,���������ʵ���Ϊ0.02 mol����n(Fe2+) : n(Fe3+) =0.01 mol: 0.01 mol=1:1���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ��ʾ�����ݻ������Ԫ�ػ��ϼ۴�����Ϊ0������
,���������ʵ���Ϊ0.02 mol����n(Fe2+) : n(Fe3+) =0.01 mol: 0.01 mol=1:1���ú�ɫ����Ļ�ѧʽ��FexOy��ʽ��ʾ�����ݻ������Ԫ�ػ��ϼ۴�����Ϊ0������![]() ����x:y=4:5��FexOy�ɱ�ʾΪFe4O5��
����x:y=4:5��FexOy�ɱ�ʾΪFe4O5��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ҫ��ũҩ��ҽҩ�м���-��ʽ�Ȼ�ͭ��CuaClb(OH)c��xH2O�ݣ�����ͨ�����²����Ʊ������� 1����ͭ�ۼ���ϡ�����У�������ͨ������Ӧ���� CuCl2����֪Fe3+�Ը÷�Ӧ�д����ã����ԭ����ͼ��ʾ������2�����Ƶõ�CuCl2��Һ�У�����ʯ �����ַ�Ӧ���Ʊ���ʽ�Ȼ�ͭ�������й�˵������ȷ����

A.ͼ��M��N�ֱ�ΪFe2+��Fe3+
B.a��b��c ֮��Ĺ�ϵʽΪ��2a=b+c
C.����1��ַ�Ӧ��������CuO��Ϊ�˳�ȥFe3+
D.���Ʊ�1 mol��CuCl2�����������ı����11.2 LO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ӷ���ʽ��д��ȷ����
A.Na2SiO3��Һ�еμ����Na2SiO3 + 2H+ = H2SiO3�� + 2Na+
B.Na2SO3ˮ�ⷽ��ʽ��SO32- + 2H2O![]() H2SO3 + 2OH-
H2SO3 + 2OH-
C.��FeBr2��Һͨ�����Cl2��2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + 4Cl- + Br2
D.�����м�Ba(OH)2���������������Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4��+ AlO2- + 2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����(B)��(Co)����(Mn)�γ�����ʱ�Ƚϸ��Ӻͱ仯��ˡ�
��1�� Co��̬ԭ�Ӻ�������Ų�ʽΪ_________���ڶ�����Ԫ�ص�һ�����ܱ�B�ߵ���______�֣�
��2���������ǹ�ҵ�Ʊ��г��õĴ�����Mn(NO3)2�еĻ�ѧ�����������⣬������______��
��3��NaBO2������֯��Ư�ס�BO2-�Ŀռ乹��Ϊ_______д���������以Ϊ�ȵ�����ķ��ӵĻ�ѧʽ��_______��
��4����ͼ��ʾƫ�������һ����������ʽ�ṹ���仯ѧʽ�ɱ�ʾΪ____(��n��ʾ��ԭ�ӵĸ���)��

��ͼ��ʾ����һ������������ӣ� ����Bԭ�ӵ��ӻ���ʽΪ________��

��5������BN������AIN��Ϊԭ�Ӿ��壬�ṹ���ƣ�BN���۵����AIN��ԭ��Ϊ_______________��
��6��һ���������ʴ�����ϵľ����ṹ����ͼ��ʾ���谢���ӵ�������ֵΪNA,�þ�����ܶ�Ϊ__gcm-3(�ú�a��NA�Ĵ���ʽ��ʾ)��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���ȷ����
A.�����ȼ����Ϊ890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4��g��+2O2��g��=CO2��g��+2H2O(g)��H=-890.3kJ��mol-1
B.500����30MPa�£���0.5molN2��g����1.5molH2��g�������ܱ������г�ַ�Ӧ����NH3��g������19.3kJ�����Ȼ�ѧ����ʽΪ��N2��g��+3H2��g��![]() 2NH3��g����H=-38.6kJ��mol-1
2NH3��g����H=-38.6kJ��mol-1
C.HCl��NaOH��Ӧ���к��ȡ�H=-57.3kJ��mol-1����H2SO4��Ca��OH��2��Ӧ���к��ȡ�H=2����-57.3��kJ��mol-1
D.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ����������ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)=2H2O(1)��H=-571.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���˴Ź���(NMR)�����ѹ㷺Ӧ���ڸ��ӷ��ӽṹ�IJⶨ��ҽѧ��ϵȸ߿Ƽ�������ֻ֪����������������Ϊ������ԭ�Ӻ���NMR�������ж���������ԭ�Ӿ��ɲ���NMR����(����)
A.18O��31P��119Sn
B.27Al��19F��12C
C.Ԫ�����ڱ��е�һ��������Ԫ�ص�ԭ��
D.Ԫ�����ڱ��е���A������Ԫ�ص�ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ҫ�Ľ������ϣ�������(��Ҫ�ɷ���Al2O3��������SiO2��Fe2O3����)�ǹ�ҵ����ȡ����ԭ�ϡ�ʵ����ģ�ҵ����������Ϊԭ����ȡAl2(SO4)3�����������[NH4Al(SO4)2��12H2O]�Ĺ���������ͼ��ʾ��

��ش��������⣺
��1������a�Ļ�ѧʽΪ________��
��2��д�����мӹ������ռ��漰���ķ�Ӧ���ӷ���ʽ______________��_____________������ͨ������CO2���巢����Ӧ�����ӷ���ʽΪ_________________��
��3�������еõ���Һc��ʵ�����Ϊ__________�����������Һ�л������������ʵ���������Ϊ(���������)________����ȴ�ᾧ������ϴ�ӡ�
��4����Һc��________�����ճ������г�����������________________����дһ������
��5����ͬʱ��ȡ���������������ͨ����������������������ֲ�Ʒ�IJ���������ʹ�Ƶõ�������������������ʵ���֮��Ϊ1��1����Ͷ��ʱ�������е�Al2O3��H2SO4�����ʵ���֮��Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ij�л���A�����ƶ���ṹ����������ʵ�飺
��1��ȡ15gA ��ȫȼ������22gCO2��9gH2O�����л����ʵ��ʽΪ_________________��
��2�������Ǽ��ø��л������Է�������Ϊ90��������ʵķ���ʽΪ__________��
��3�������л�����Ũ���Ṳ�ȵ������£����������ᷴӦ���������Ҵ���Ӧ������2����A ��Ӧ���ɺ���Ԫ�������ʣ���A �Ľṹ��ʽΪ__________________��
��4��д��A�������۷�Ӧ���ɸ߷��ӻ�����ķ���ʽ___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�����ʵķ������ᴿ�ǻ�ѧ���ص㣬���������ʵ��Ŀ�ģ��ֱ�ѡ����Ӧ�IJ�����ʵ��װ�á�����Ϊ������
a������ b���ᾧ�� c��������ˮ������ d�����ȣ������գ� e�����������ᣬ���� f����ȡ��Һ g����Һ h������
����Ϊʵ��װ�ã�
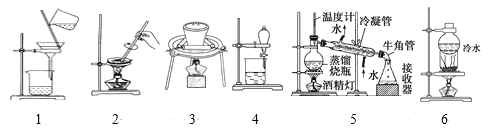
��1���ӵ�ˮ����ȡ�⣺___��__�����ֱ��������ż�ʵ��װ��ͼ��ţ���ͬ����
��2����ȥ�������е�̼��ƣ�___��___��
��3����ȥ���ᱵ�е�����أ�___��___��
��4���������ϸɳ�͵�ķ�����___��___��
��5����ȥ�Ȼ��ƾ����е�̼���ƣ�___��__��
��6���������ᣨ�е�118�棩�������������е�77.1�棩�Ļ��Һ�������ܣ���__��_��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com