
【题目】下列离子方程式书写正确的是
A.Na2SiO3溶液中滴加盐酸:Na2SiO3 + 2H+ = H2SiO3↓ + 2Na+
B.Na2SO3水解方程式:SO32- + 2H2O![]() H2SO3 + 2OH-
H2SO3 + 2OH-
C.向FeBr2溶液通入过量Cl2:2Fe2+ + 2Br- + 2Cl2 = 2Fe3+ + 4Cl- + Br2
D.明矾中加Ba(OH)2至沉淀的质量最大:Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O
【答案】D
【解析】
A. 向Na2SiO3溶液中滴加稀盐酸:SiO32- +2H+=H2SiO3↓,Na2SiO3是强电解质,选项A错误;
B.亚硫酸根离子的水解分步进行,其水解的离子方程式需要分步写,主要写出第一步水解即可,正确的水解离子方程式为:SO32-+H2OHSO3-+OH-,选项B错误;
C.向FeBr2溶液中通入过量的Cl2的离子方程式为2Fe2++4Br-+ 3Cl2 = 2Fe3++2Br2+6Cl-,选项C错误;
D.当沉淀的质量恰好最大时,Al3+完全转化为AlO2- ,这时离子方程式是Al3+ + 2SO42- + 2Ba2+ + 4OH- = 2BaSO4↓+ AlO2- + 2H2O,选项D正确。
答案选D。


科目:高中化学 来源: 题型:
【题目】下列图示方法不能完成相应实验的是
A.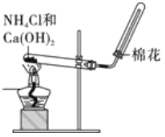 实验室制取并收集NH3
实验室制取并收集NH3
B.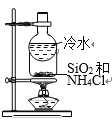 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C. 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D.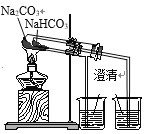 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g
B.25℃、101.3kPa时,11.2LH2中含有的原子数为NA
C.10 mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.1mol/L Na2SO4溶液中离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
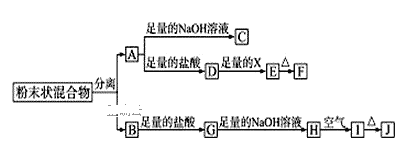
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用碱性溶液吸收多余的氯气,防止环境污染。某次实验中,将多余的氯气用100 mL 2.00 mol·L1的NaOH溶液恰好完全吸收,测得吸收液中ClO与ClO3的物质的量之比为5:1。
(1)吸收的氯气的物质的量为_____________。
(2)吸收液中Cl的物质的量浓度为______________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应3Cl2+6NaOH![]() 5NaCl+NaClO3+3H2O,以下叙述正确的是( )
5NaCl+NaClO3+3H2O,以下叙述正确的是( )
A. Cl2既做氧化剂又做还原剂
B. 被氧化的氯原子和被还原的氯原子的物质的量之比为5∶1
C. Cl2是氧化剂,NaOH是还原剂
D. 氧化剂得电子数与还原剂失电子数之比为5∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
I.研究小组用炼铁厂的铁矾渣制备FeCO3,铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。
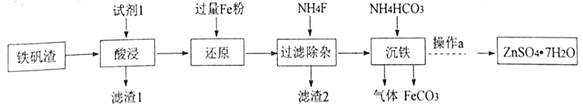
(1)试剂1是过量的_______,滤渣 2的成分是__________ (写化学式);
(2)“沉铁”发生反应的离子方程式是____________;
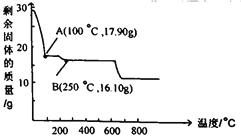
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是__,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100°C时所得固体的化学式____。
II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。
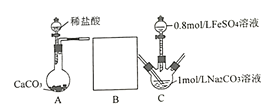
(1)画出装置B______________,B中所用试剂为______________;
(2)先向1mol/L Na2CO3溶液中通入CO2的目的是_________________________;
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是_______________(不考虑操作不当引起的误差)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
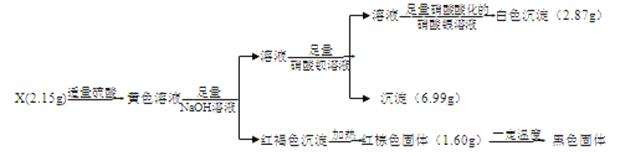
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关晶体的叙述中正确的是( )
A.在SiO2晶体中,由Si、O构成的最小单元环中共有8个原子
B.在28g晶体硅中,含Si﹣Si共价键个数为4NA
C.金刚石的熔沸点高于晶体硅,是因为C﹣C键键能小于Si﹣Si键
D.镁型和铜型金属晶体的配位数均为12
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com