
【题目】重要的农药、医药中间体-碱式氯化铜[CuaClb(OH)c·xH2O],可以通过以下步骤制备。步骤 1:将铜粉加入稀盐酸中,并持续通空气反应生成 CuCl2。已知Fe3+对该反应有催化作用,其催化原理如图所示。步骤2:在制得的CuCl2溶液中,加入石 灰乳充分反应后即可制备碱式氯化铜。下列有关说法不正确的是

A.图中M、N分别为Fe2+、Fe3+
B.a、b、c 之间的关系式为:2a=b+c
C.步骤1充分反应后,加入少量CuO是为了除去Fe3+
D.若制备1 mol的CuCl2,理论上消耗标况下11.2 LO2
【答案】A
【解析】
由实验步骤及转化图可知,发生反应2Cu+O2+4HCl===2CuCl2+2H2O, N为Fe2+,M为Fe3+,在制得在制得的CuCl2溶液中,加入石灰乳充分反应后即可制备碱式氯化铜,且化合物中正负化合价代数和为0,依此结合选项解答问题。
A.根据上述分析,N为Fe2+,M为Fe3+,A选项错误;
B.根据化合物中正负化合价的代数和为0,可知2a=b+c,B选项正确;
C.Fe3+水解使溶液显酸性,CuO与H+反应产生Cu2+和水,当溶液的pH增大到一定程度,Fe3+形成Fe(OH)3而除去,从而达到除去Fe3+的目的,C选项正确;
D.根据方程式2Cu+O2+4HCl===2CuCl2+2H2O,若制备1 mol的CuCl2,理论上消耗0.5molO2,标况下,![]() ,D选项正确;
,D选项正确;
答案选A。


科目:高中化学 来源: 题型:
【题目】下列图示装置所表示的实验中,没有发生氧化还原反应的是
|
|
|
|
A.蘸有浓盐酸和浓氨水的玻璃棒靠近 | B.铝丝伸入硫酸铜溶液中 | C.测定空气中氧气含量 | D.向蔗糖中加入浓硫酸 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示方法不能完成相应实验的是
A.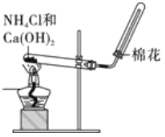 实验室制取并收集NH3
实验室制取并收集NH3
B.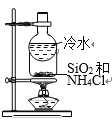 分离SiO2和NH4Cl
分离SiO2和NH4Cl
C. 检验草酸晶体中是否含有结晶水
检验草酸晶体中是否含有结晶水
D.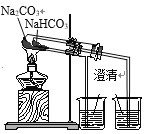 验证热稳定性:Na2CO3>NaHCO3
验证热稳定性:Na2CO3>NaHCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某合金粉末除含铝外,还含有铁、铜中的一种或两种,某兴趣小组在老师的指导下,对合金中铁、铜的存在情况进行了如下探究。
(查阅资料)铁、铜不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中,除含铝外,还含有铁。
猜想2:该合金粉末中,除含铝外,还含有铜。
猜想3:该合金粉末中,除含铝外,还含有_________(填名称)。
(实验探究)下列实验仅供选择的试剂是:10%的盐酸、30%的氢氧化钠溶液。
实验方案 | 实验现象 | 结论 |
①取一定量的合金粉末,加过量的____,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气体放出。 | 合金中一定含有铝。 |
②取步骤①所得滤渣,加过量的______,充分反应。 | 滤渣粉末部分溶解,并有气体放出,溶液呈现浅绿色。 | 合金中一定含有______。 |
(探究结论)猜想3成立。
(反思)一般来说,活泼金属能与盐酸等酸反应,而铝与酸、碱都能反应,说明铝具有特殊的性质。写出铝与氢氧化钠溶液反应的离子方程式__________。
(知识延伸)在一定条件下,铁和铝都能与水反应。写出在相应条件下,铁和水发生反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.地球上最基本的能源是太阳能,大自然中利用太阳能最成功的是植物的光合作用
B.将植物的秸秆等加入沼气发酵池中,在富氧条件下,经过沼气细菌的作用,生成沼气
C.水煤气经过催化合成可以得到甲醇等燃料
D.贮氢合金并不是简单的吸附氢气,而是通过化学反应贮存氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某二元酸H2MO4在水中电离分以下两步:H2MO4H++HMO4-,HMO4-H++MO42-。常温下向20 mL0.1mol/L NaHMO4溶液中滴入cmol/LNaOH溶液,溶液温度与滴入NaOH溶液体积关系如图。下列说法正确的是

A.该氢氧化钠溶液pH=12
B.图像中F点对应的溶液中c(OH-)>c(HMO4-)
C.滴入NaOH溶液过程中水的电离程度一直增大
D.图像中G点对应的溶液中c(Na+)=c(HMO4-)+2c(MO42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述正确的是( )
A.标准状况下,分子数为NA的CO、N2混合气体体积约为22.4L,质量为28g
B.25℃、101.3kPa时,11.2LH2中含有的原子数为NA
C.10 mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8%
D.1mol/L Na2SO4溶液中离子总数为3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组用含A、B两种金属单质的粉末状混合物进行如下实验,其转化关系如图所示(部分反应物或生成物未列出),其中E为白色沉淀,I为红褐色沉淀。
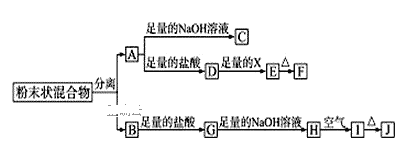
(1)写出下列物质的化学式:F___,G___。
(2)分离粉末状混合物最简单的方法是___。
(3)D→E转化中,加入足量的X,试剂X可能是___,写出其离子方程式___。
A.饱和NaCl溶液 B.NaOH溶液 C.氨水 D.Ba(OH)2溶液
(4)A→C的离子方程式___。
(5)检验G溶液中的阳离子的方法___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
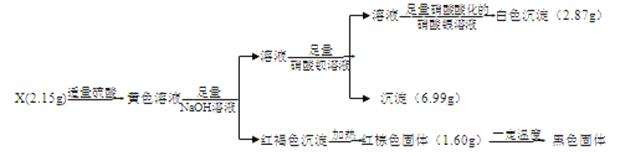
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com