
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
【答案】D
【解析】
燃烧热指在25C°、101kPa时,1mol纯物质完全燃烧生成稳定的氧化物时所放出的热量;稀溶液中,酸跟碱发生中和反应生成1 mol液态水时所释放的热量叫做中和热,据此回答问题。
A.甲烷的燃烧热为890.3kJ·mol-1,要生成液态水,甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(l) △H=-890.3kJ·mol-1,A错误;
B.500℃、30MPa下,将0.5molN2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热19.3kJ,由于反应为可逆反应,则1molN2完全反应放热大于38.6kJ,其热化学反应方程式为:N2(g)+3H2(g)2NH3(g)△H<-38.6 kJ/mol,B错误;
C.中和热是指在稀溶液中,强酸和强碱反应生成1mol水时放出的热量,其衡量标准是生成的水为1mol,故无论稀H2SO4和Ca(OH)2反应生成的水是几摩尔,其中和热恒为57.3kJ/mol,C错误;
D.在101kPa时,2gH2的物质的量为1mol,完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1,D正确;
答案为D。


 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
A.地球上最基本的能源是太阳能,大自然中利用太阳能最成功的是植物的光合作用
B.将植物的秸秆等加入沼气发酵池中,在富氧条件下,经过沼气细菌的作用,生成沼气
C.水煤气经过催化合成可以得到甲醇等燃料
D.贮氢合金并不是简单的吸附氢气,而是通过化学反应贮存氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室常用碱性溶液吸收多余的氯气,防止环境污染。某次实验中,将多余的氯气用100 mL 2.00 mol·L1的NaOH溶液恰好完全吸收,测得吸收液中ClO与ClO3的物质的量之比为5:1。
(1)吸收的氯气的物质的量为_____________。
(2)吸收液中Cl的物质的量浓度为______________(溶液体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸盐在无机试剂制备中应用广泛。某研究小组用如下两种方法制备FeCO3。已知: FeCO3 是白色固体,难溶于水。
I.研究小组用炼铁厂的铁矾渣制备FeCO3,铁矾渣主要含有K2Fe6(SO4)4(OH)12、ZnO、Fe2O3及少量的CaO、MgO、 SiO2 等。
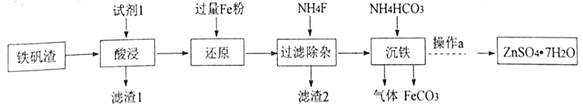
(1)试剂1是过量的_______,滤渣 2的成分是__________ (写化学式);
(2)“沉铁”发生反应的离子方程式是____________;
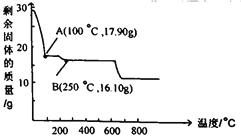
(3)沉铁后的滤液经“操作a”,再经过“过滤、 洗涤、干燥”得到皓矾(ZnSO4·7H2O),“操作a”是__,取28.70g皓矾(ZnSO4·7H2O)加热,剩余固体的质量变化如图,100°C时所得固体的化学式____。
II.研究小组又采用如下装置制取FeCO3 (C后及夹持装置略)。操作的关键是向Na2CO3溶液(pH=12.11)通入一段时间CO2至溶液pH为7,再滴加一定量FeSO4溶液,产生白色沉淀。
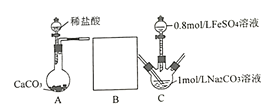
(1)画出装置B______________,B中所用试剂为______________;
(2)先向1mol/L Na2CO3溶液中通入CO2的目的是_________________________;
(3)FeCO3溶于乳酸[CH3CH(OH)COOH]能制得可溶性乳酸亚铁补血剂,该实验小组用KMnO4测定补血剂中亚铁含量进而计算乳酸亚铁的质量分数,发现乳酸亚铁的质量分数总是大于100%,其原因是_______________(不考虑操作不当引起的误差)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G是某抗炎症药物的中间体,其合成路线如下:
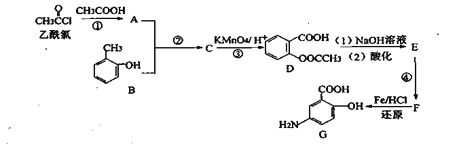
已知:①![]()
![]()
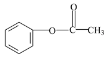
② ![]()
![]()
![]() (呈碱性,易氧化)
(呈碱性,易氧化)
(1)C的官能团名称是_______________;
(2)反应①的反应类型为___________;反应②的作用是___________________;
(3)下列对有机物G的性质推测不正确的是____________________ (填选项字母);
A.1molG与足量NaHCO3溶液反应放出2molCO2
B.能发生取代反应和氧化反应
C.能加聚合成高分子化合物
D.具有两性,既能与酸反应也能与碱反应
(4)写出E→F的化学反应方程式______________________________;
(5)同时符合下列条件的D的同分异构体有__________种:
①含有苯环且能发生水解反应:②能发生银镜反应;③能与NaHCO3溶液反应放出CO2。
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻、对位:苯环上有发基时,新引入的取代基连在苯环的问位。根据题中的信息,写出以甲苯为原料合成有机物的流程图 (无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X
(无机试剂任选)_______________________________________________________________________________________。 合成路线流程图示例:X![]() Y
Y![]() Z……目标产物
Z……目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.化合物X含有三种元素,其中两种为非金属元素,且原子个数比为1:1,X不溶于水,能溶于强酸。某研究小组为探究其组成和性质,设计并完成了如下实验。
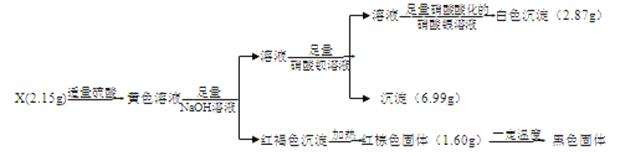
(1)X的化学式是____________________。
(2)写出检验黄色溶液中金属阳离子的实验操作:__________。
(3)黄色溶液中加入铜片,铜片表面被腐蚀,则对应的离子方程式是:_____________________。
II.已知黑色固体中不含单质。为进一步探究其组成,研究小组将上述所得固体全部溶于稀盐酸,配成100mL溶液,每次取20.00mL待测液于锥形瓶中,用2.000×10-2molL-1 KMnO4标准溶液进行滴定,并记录实验的结果如下表:
组次 | 1 | 2 | 3 | 4 |
V标(mL) | 20.00 | 20.02 | 19.99 | 19.99 |
(4)如何判断滴定终点:__________________。
(5)待测液中c(Fe2+) = ____________________。
(6)该黑色固体的化学式用FexOy形式可表示为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取a mol某含氧衍生物的蒸气,使其与2a mol O2混合点燃,两者恰好完全反应,生成等体积的CO2和水蒸气,反应后混合气体的密度较反应前减少了![]() (均在相同条件下测定),则该有机物的分子式为 ( )
(均在相同条件下测定),则该有机物的分子式为 ( )
A.C2H4B.C3H6O2C.C2H4O2D.C4H8O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化钠(NaBH4)在化工等领域具有重要的应用价值,某研究小组采用偏硼酸钠NaBO2为主要原料制备NaBH4,其流程如下:
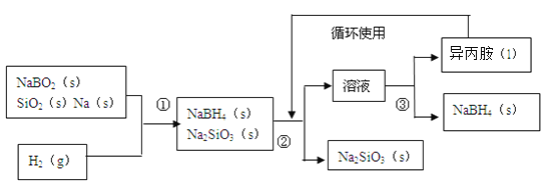
已知:NaBH4常温下能与水反应,可溶于异丙胺(沸点:33℃)。
(1)在第①步反应加料之前,需要将反应器加热至100℃以上并通入氩气,该操作的目的是_____,原料中的金属钠通常保存在____中,实验室取用少量金属钠需要用到的实验用品有_____,_____,玻璃片和小刀等。
(2)请配平第①步反应的化学方程式:□NaBO2+□SiO2+□Na+□H2=□NaBH4+□Na2SiO3 ______________
(3)第②步分离采用的方法是______;第③步分离(NaBH4)并回收溶剂,采用的方法是______。
(4)NaBH4(s)与水(l)反应生成NaBO2(s)和氢气(g),在25℃,101kPa下,已知每消耗3.8克NaBH4(s)放热21.6kJ,该反应的热化学方程式是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,可用下列方法合成。首先,由A制得E,过程如下:
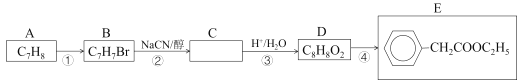
已知:i.CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
ii.CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
(1)烃A的名称是___。D的同分异构体中,能发生银镜反应的芳香族化合物有多种,任写一种该类同分异构体的结构简式___。写出反应④的化学方程式___。
又已知,iii:R—CH2—COOCH2R’+HCOOCH2R”![]() +R”—CH2OH
+R”—CH2OH
然后,通过下列路线可得最终产品:
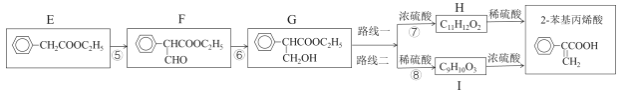
(2)检验F是否完全转化为G的试剂是___。反应⑤的化学方程式是___。
(3)路线二与路线一相比不太理想,理由是___。
(4)设计并完善以下合成流程图___。

(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com