
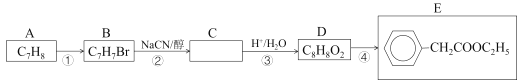
【题目】2-苯基丙烯酸(俗名阿托酸)是一种重要的医药中间体、材料中间体,可用下列方法合成。首先,由A制得E,过程如下:
已知:i.CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
ii.CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
(1)烃A的名称是___。D的同分异构体中,能发生银镜反应的芳香族化合物有多种,任写一种该类同分异构体的结构简式___。写出反应④的化学方程式___。
又已知,iii:R—CH2—COOCH2R’+HCOOCH2R”![]() +R”—CH2OH
+R”—CH2OH
然后,通过下列路线可得最终产品:
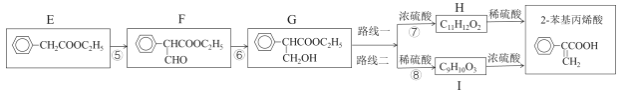
(2)检验F是否完全转化为G的试剂是___。反应⑤的化学方程式是___。
(3)路线二与路线一相比不太理想,理由是___。
(4)设计并完善以下合成流程图___。

(合成路线常用的表示方式为:A![]() B……
B……![]() 目标产物)
目标产物)
【答案】甲苯 ![]() (或
(或![]() 等)
等) ![]() +CH3CH2OH
+CH3CH2OH![]() +H2O 新制的氢氧化铜悬浊液(或银氨溶液)
+H2O 新制的氢氧化铜悬浊液(或银氨溶液) ![]() +HCOOC2H5
+HCOOC2H5![]() +C2H5OH 由于I中既有羟基又有羧基,在浓硫酸的作用下易发生酯化反应,影响2-苯基丙烯酸的产率
+C2H5OH 由于I中既有羟基又有羧基,在浓硫酸的作用下易发生酯化反应,影响2-苯基丙烯酸的产率 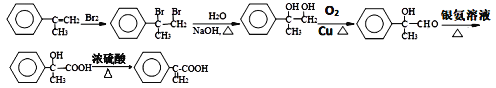
【解析】
A的分子式为C7H8,又E中有苯环结构,则A为甲苯;A发生卤代反应生成B,因为E中苯环上只有一个支链,可知甲苯发生的是侧链上的卤代,B为![]() ;发生已知i的反应生成C(
;发生已知i的反应生成C(![]() ),
),![]() 发生已知ii的反应生成D(
发生已知ii的反应生成D(![]() );H为G在浓硫酸加热条件下发生消去反应得到,则H为
);H为G在浓硫酸加热条件下发生消去反应得到,则H为![]() ,I为G在稀硫酸加热条件下发生水解反应得到,则I为
,I为G在稀硫酸加热条件下发生水解反应得到,则I为![]() 。
。
(1)由分析可知烃A是甲苯;能发生银镜反应,则分子结构中含有酯基,满足条件的D的同分异构的结构简式有![]() 、
、![]() 等;④
等;④![]() 与乙醇发生酯化反应,化学方程式为
与乙醇发生酯化反应,化学方程式为![]() +CH3CH2OH
+CH3CH2OH![]() +H2O,故答案为:甲苯;
+H2O,故答案为:甲苯;![]() (或
(或![]() 等);
等);![]() +CH3CH2OH
+CH3CH2OH![]() +H2O;
+H2O;
(2)F中有醛基,能产生镜现象,或能使新制的氢氧化铜悬浊液产生红色沉淀,则检验F是否完全转化为G的试剂是新制的氢氧化铜悬浊液(或银氨溶液);反应⑤为![]() 发生已知iii的反应,其化学方程式是
发生已知iii的反应,其化学方程式是![]() +HCOOC2H5
+HCOOC2H5![]() +C2H5OH ,故答案为:新制的氢氧化铜悬浊液(或银氨溶液);
+C2H5OH ,故答案为:新制的氢氧化铜悬浊液(或银氨溶液);![]() +HCOOC2H5
+HCOOC2H5![]() +C2H5OH;
+C2H5OH;
(3)由于I中既有羟基又有羧基,在浓硫酸的作用下易发生酯化反应,影响2-苯基丙烯酸的产率,所以路线二与路线一相比不太理想,故答案为:由于I中既有羟基又有羧基,在浓硫酸的作用下易发生酯化反应,影响2-苯基丙烯酸的产率;
(4)![]() 中有双键,可先与溴发生加成反应,后在氢氧化钠水溶液加热条件下发生水解,再进行醇羟基逐步氧化可的到
中有双键,可先与溴发生加成反应,后在氢氧化钠水溶液加热条件下发生水解,再进行醇羟基逐步氧化可的到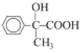 ,其合成路线为:
,其合成路线为: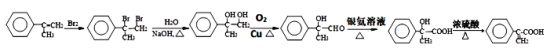 。
。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中,正确的是
A.甲烷的燃烧热为890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+2H2O(g)△H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5molN2(g)和1.5molH2(g)置于密闭容器中充分反应生成NH3(g)放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g)△H=-38.6kJ·mol-1
2NH3(g)△H=-38.6kJ·mol-1
C.HCl和NaOH反应的中和热△H=-57.3kJ·mol-1,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ·mol-1
D.在101kPa时,2gH2完全燃烧生成液态水,放出285.8kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)=2H2O(1)△H=-571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
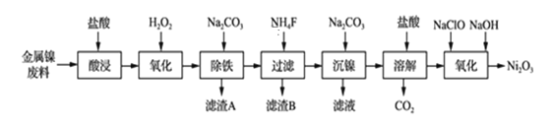
【题目】NiCl2是化工合成中最重要的镍源,工业上以金属镍废料(含Fe、Ca、Mg等杂质)为原料生产NiCl2,继而生产Ni2O3的工艺流程如下:
流程中相关金属离子生成氢氧化物沉淀的pH如下表所示:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.1 | 6.5 | 7.1 |
沉淀完全的pH | 3.2 | 9.7 | 9.2 |
(1)为了提高镍元素的浸出率,在“酸浸”时可采取的措施有:①适当升高温度;②搅拌;③_______________等。
(2)加入H2O2的目的是____________,所发生的离子方程式为____________________。
(3)“除铁”时,控制溶液pH的范围为_____________________。
(4)滤渣B的主要成分的化学式为___________________,滤液中的阳离子有________。
(5)“氧化”生成Ni2O3的离子方程式为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(_____)两种物质都不是电解质
(_____)两种物质都是钠的化合物
(_____)两种物质都是氧化物
(_____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为___。
②证明有红褐色胶体生成的实验操作是__。
(3)以下A~D四个涉及H2O2的反应,请填空:
A.Na2O2+2HCl=H2O2+2NaCl
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.![]() H2O2+
H2O2+![]() KMnO4+
KMnO4+![]() H2SO4→
H2SO4→![]() MnSO4+
MnSO4+![]() K2SO4+
K2SO4+![]() H2O+
H2O+![]() O2↑
O2↑
①配平D方程式,系数填在方框内__;该反应的还原剂是__;
②H2O2既体现氧化性,又体现还原性的反应是__,H2O2既不作氧化剂又不作还原剂的反应是__。(请用代号作答)
③请用双线桥法表示B反应中电子转移的方向和数目:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上可由氢气、氮气合成氨气,溶于水形成氨水。一定温度下,向2L固定体积的密闭容器中加入N2(g)和H2(g),发生反应:N2(g)+3H2(g)![]() 2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
2NH3(g)+Q(Q>0),NH3物质的量随时间的变化如图所示。
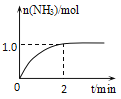
(1)0~2min内的平均反应速率v(H2)=___。
(2)该温度下,反应的平衡常数表达式K=___。
其平衡常数K与温度T的关系如下表:
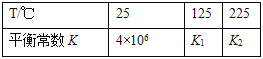
试判断K1___K2(填写“>”、“=”或“<”)。
(3)能说明该合成氨反应已达到平衡状态的是___(选填编号)。
a.3v(N2)=v(H2)
b.容器内压强保持不变
c.混合气体的密度保持不变
d.25℃时,测得容器中c(NH3)=0.2mol·L-1,c(H2)=c(N2)=0.01mol·L-1
常温下,某同学将盐酸与氨水等体积混合,两种溶液的浓度和混合后所得溶液的pH如表。
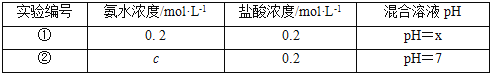
请回答:
(4)①中所得混合溶液,pH___7(填“>”、“<”或“=”);②中c__0.2(填“>”、“<”或“=”),所得混合溶液中各离子浓度大小关系为___。
(5)请你设计一个能证明一水合氨是弱电解质的简要方案___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的分离与提纯是化学的重点,请根据下列实验目的,分别选择相应的操作和实验装置。下列为操作:
a.蒸馏 b.结晶法 c.加适量水,过滤 d.加热(或灼烧) e.加适量盐酸,蒸发 f.萃取分液 g.分液 h.升华
下列为实验装置:
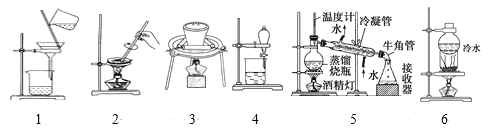
(1)从碘水中提取碘:___、__。(分别填操作序号及实验装置图编号,下同)。
(2)除去氧化钙中的碳酸钙:___、___。
(3)除去硫酸钡中的硝酸钾:___、___。
(4)分离固体细沙和碘的方法:___、___。
(5)除去氯化钠晶体中的碳酸钠:___、__。
(6)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶):__、_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。
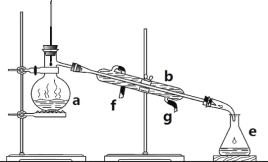
(1)写出下列仪器的名称:b.__;e___;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是___,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由__(填f或g)口通入,另一口流出。仪器a___(填能或不能)直接加热。
(3)实验时a中除加入少量自来水外,还需加入少量__,其作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com