
����Ŀ����ͼΪһ��������ͼ����С����ͼ���Ϸֱ�д��H2��CO2��Na2O��NaCl��FeCl3�������ʣ�ͼ���������������ʾ��ɹ���Ϊһ�࣬�ཻ����A��B��C��DΪ����Ӧ�ķ������ݴ��š���ش��������⣺

��1���뽫�������ݴ���������Ӧ�������ڣ�
��_____���������ʶ����ǵ����
��_____���������ʶ����ƵĻ�����
��_____���������ʶ���������
��_____���������ʶ�����
��2���ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ�����ͼ��ij������M�ı�����Һ�������������Һ�ʺ��ɫ��
������M�Ļ�ѧʽΪ___��
��֤���к��ɫ�������ɵ�ʵ�������__��
��3������A��D�ĸ��漰H2O2�ķ�Ӧ������գ�
A.Na2O2��2HCl��H2O2��2NaCl
B.Ag2O��H2O2��2Ag��O2����H2O
C.2H2O2��2H2O��O2��
D.![]() H2O2��
H2O2��![]() KMnO4��
KMnO4��![]() H2SO4��
H2SO4��![]() MnSO4��
MnSO4��![]() K2SO4��
K2SO4��![]() H2O��
H2O��![]() O2��
O2��
����ƽD����ʽ��ϵ�����ڷ�����__���÷�Ӧ�Ļ�ԭ����__��
��H2O2�����������ԣ������ֻ�ԭ�Եķ�Ӧ��__��H2O2�Ȳ����������ֲ�����ԭ���ķ�Ӧ��__��(���ô�������)
������˫���ŷ���ʾB��Ӧ�е���ת�Ƶķ������Ŀ��__��
���𰸡�A C B D FeCl3 ��һ���������ձ��е����ʣ����ܷ��������ЧӦ��֤��������Fe(OH)3���� 2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2��+8H2O H2O2 C A 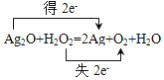
��������
��1��A��ʾ�����������ʶ����ǵ���ʣ�B��ʾ�����������ʶ��������C��ʾ�����������ʶ����ƵĻ����D��ʾ�����������ʶ����Ρ�
��2�����������У�ֻ��FeCl3��ˮ��Һ�п����γɽ��壬�Ʊ�������������ʱ��Ӧ�������Ȼ�����Һ�����ˮ�У���������С�
��3��A.Na2O2��2HCl��H2O2��2NaCl��H2O2�Ǹ��ֽⷴӦ�IJ���Ȳ����������ֲ�����ԭ����
B.Ag2O��H2O2��2Ag��O2����H2O��H2O2�ǻ�ԭ����
C.2H2O2��2H2O��O2����H2O2�����������ԣ������ֻ�ԭ�ԣ�
D.![]() H2O2��
H2O2��![]() KMnO4��
KMnO4��![]() H2SO4��
H2SO4��![]() MnSO4��
MnSO4��![]() K2SO4��
K2SO4��![]() H2O��
H2O��![]() O2��
O2��
��ƽʱ�����ݻ��ϼ������뽵��������ȣ�����ȷ��H2O2��KMnO4�Ļ�ѧ��������Ȼ�����������غ����������ʵĻ�ѧ��������
˫���ŷ���ʾB��Ӧ�е���ת�Ƶķ������Ŀ��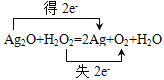 ��
��
��1���������ڵ��ʣ�����ʱ����ǻ���������ڵ���ʵķ��룬������̼��ˮ��Һ�ܵ��磬�����ɵ�̼�ᵼ�磬���߲����ڵ���ʣ�������Ԫ�صĻ������������ƺ��Ȼ��ƣ�������̼����������������Ԫ����ɣ�һ������Ԫ�أ�����������Ȼ��ƺ��Ȼ������ܵ������������Ӻͽ��������ӵĻ�����������࣬��Ϊ��A��C��B��D��
��2�����ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ����Ȼ����ı�����Һ��������п��Ƶ�һ�ֺ��ɫ�����������壬M�Ļ�ѧʽΪ��FeCl3���ڽ�����ж����������Һû�У����Կ�����һ���������ձ��е����ʣ����ܷ��������ЧӦ��֤��������Fe(OH)3���塣��Ϊ��FeCl3����һ���������ձ��е����ʣ����ܷ��������ЧӦ��֤��������Fe(OH)3���壻
��3����KMnO4��Mn�Ļ��ϼ�Ϊ+7�ۣ���Ӧ������MnSO4�����ϼ۱��+2��MnԪ�ػ��ϼ۽��ͱ���ԭ�����ϼ۽�����5�ۣ�H2O2����Ԫ�ػ��ϼ�Ϊ-1�ۣ���Ӧ������0�۵�O�����ϼ�������1�ۣ�1����˫��ˮ��Ӧ�����ٻ��ϼ�����2�ۣ����ϼ۱仯����С������Ϊ10������KMnO4�ļ�����Ϊ2��˫��ˮ�ļ�����Ϊ5��Ȼ�����ù۲취��ƽ�������ʣ���ƽ��ķ���ʽΪ2KMnO4+5H2O2+3H2SO4=K2SO4+2MnSO4+5O2��+8H2O����Ӧ��˫��ˮ�е�O��������˫��ˮΪ��ԭ�����ʴ�Ϊ��2KMnO4+5H2O2+3H2SO4= K2SO4+2MnSO4+5O2��+ 8H2O��H2O2��
��A.Na2O2+2HCl=H2O2+2NaCl����һ����������ԭ��Ӧ��˫��ˮ�Ȳ�����������Ҳ���ǻ�ԭ����
B.Ag2O+H2O2=2Ag+O2+H2O��Ag2O����ԭ�ɵ�������H2O2������Ϊ��ԭ�ԣ�������Ԫ��ת��ΪO2��
C.2H2O2=2H2O+O2������������ķֽⷴӦ����һ������������ԭ��Ӧ��H2O2�ȱ����������ԣ��ֱ����˻�ԭ�ԣ�
D.H2O2��KMnO4��H2SO4�� MnSO4��K2SO4��H2O��O2����˫��ˮ�ڷ�Ӧ��OԪ�صĻ��ϼ���-1���0�����ϼ����߱�������˫��ˮ������ԭ����
����H2O2�����������ԣ������ֻ�ԭ�Եķ�Ӧ��C��H2O2�Ȳ����������ֲ�����ԭ���ķ�Ӧ��A���ʴ�Ϊ��C��A��
��Ag2O+H2O2=2Ag+O2+H2O��Ag2O����ԭ�ɵ���������2e-��H2O2������Ϊ��ԭ�ԣ�������Ԫ��ת��ΪO2��ʧ2e-����Ӧ�е���ת�Ƶķ������Ŀ��˫���ŷ���ʾΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���������Լ��Ʊ���Ӧ�ù㷺��ij�о�С�����������ַ����Ʊ�FeCO3����֪�� FeCO3 �ǰ�ɫ���壬������ˮ��
I���о�С�������������������Ʊ�FeCO3����������Ҫ����K2Fe6(SO4)4(OH)12��ZnO��Fe2O3��������CaO��MgO�� SiO2 �ȡ�
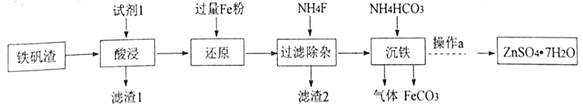
��1���Լ�1�ǹ�����_______������ 2�ijɷ���__________ (д��ѧʽ)��
��2����������������Ӧ�����ӷ���ʽ��____________��
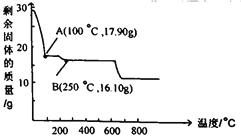
��3�����������Һ��������a�����پ��������ˡ� ϴ�ӡ�����õ�𩷯(ZnSO4��7H2O)��������a����__��ȡ28.70g𩷯(ZnSO4��7H2O)���ȣ�ʣ�����������仯��ͼ��100��Cʱ���ù���Ļ�ѧʽ____��
II���о�С���ֲ�������װ����ȡFeCO3 (C�г�װ����)�������Ĺؼ�����Na2CO3��Һ(pH=12.11)ͨ��һ��ʱ��CO2����ҺpHΪ7���ٵμ�һ����FeSO4��Һ��������ɫ������
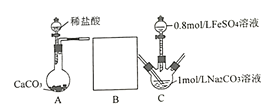
��1������װ��B______________��B�������Լ�Ϊ______________��
��2������1mol/L Na2CO3��Һ��ͨ��CO2��Ŀ����_________________________��
��3��FeCO3��������[CH3CH(OH)COOH]���Ƶÿ���������������Ѫ������ʵ��С����KMnO4�ⶨ��Ѫ�����������������������������������������������������������������Ǵ���100%����ԭ����_______________(�����Dz���������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����⻯�ƣ�NaBH4���ڻ��������������Ҫ��Ӧ�ü�ֵ��ij�о�С�����ƫ������NaBO2Ϊ��Ҫԭ���Ʊ�NaBH4�����������£�
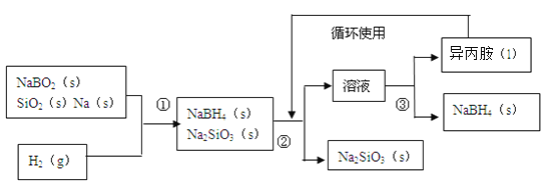
��֪��NaBH4����������ˮ��Ӧ����������������е㣺33������
��1���ڵڢٲ���Ӧ����֮ǰ����Ҫ����Ӧ��������100�����ϲ�ͨ��������ò�����Ŀ����_____��ԭ���еĽ�����ͨ��������____�У�ʵ����ȡ��������������Ҫ�õ���ʵ����Ʒ��_____��_____������Ƭ��С���ȡ�
��2������ƽ�ڢٲ���Ӧ�Ļ�ѧ����ʽ����NaBO2+��SiO2+��Na+��H2=��NaBH4+��Na2SiO3 ______________
��3���ڢڲ�������õķ�����______���ڢ۲����루NaBH4���������ܼ������õķ�����______��
��4��NaBH4��s����ˮ��l����Ӧ����NaBO2��s����������g������25����101kPa�£���֪ÿ����3.8��NaBH4��s������21.6kJ���÷�Ӧ���Ȼ�ѧ����ʽ��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йؾ������������ȷ���ǣ� ��
A����SiO2�����У���Si��O���ɵ���С��Ԫ���й���8��ԭ��
B����28g������У���Si��Si���ۼ�����Ϊ4NA
C�����ʯ���۷е���ھ���裬����ΪC��C������С��Si��Si��
D��þ�ͺ�ͭ�ͽ����������λ����Ϊ12
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ۺͻ���̿�Ļ������NaCl��Һ�����������ͼװ���У��������ĵ绯ѧ��ʴʵ�顣�����йظ�ʵ���˵����ȷ���ǣ� ��
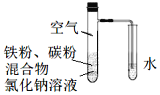
A.���������ĵ缫��ӦʽΪFe�C3e=Fe3+
B.����ʴ�����л�ѧ��ȫ��ת��Ϊ����
C.����̿�Ĵ��ڻ�������ĸ�ʴ
D.��ˮ����NaCl��Һ�������ܷ���������ʴ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ������С��36��X��Y��Z��W����Ԫ�أ�X��̬ԭ�ӵ����������������ڲ��������2����Y��̬ԭ�ӵ�2pԭ�ӹ������3��δ�ɶԵ��ӣ�Z�ǵؿ��к�������Ԫ�أ�W��ԭ������Ϊ24��
��1��W��̬ԭ�ӵĺ�������Ų�ʽΪ___________��Ԫ��X��Y��Z�ĵ�һ�������ɴ�С��˳��Ϊ___________(��Ԫ�ط��ű���)��
��2����XYZ-��Ϊ�ȵ�����Ļ�ѧʽΪ___________��
��3��1molHYZ3�����к�����������ĿΪ___________��
��4��YH3��������ˮ����Ҫԭ����___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2-������ϩ��(����������)��һ����Ҫ��ҽҩ�м��塢�����м��壬�������з����ϳɡ����ȣ���A�Ƶ�E���������£�
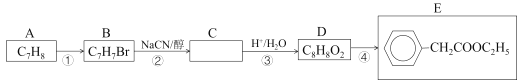
��֪��i.CH3CH2Br+NaCN![]() CH3CH2CN+NaBr
CH3CH2CN+NaBr
ii.CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
��1����A��������___��D��ͬ���칹���У��ܷ���������Ӧ�ķ����廯�����ж��֣���дһ�ָ���ͬ���칹��Ľṹ��ʽ___��д����Ӧ�ܵĻ�ѧ����ʽ___��
����֪��iii��R��CH2��COOCH2R��+HCOOCH2R��![]() +R����CH2OH
+R����CH2OH
Ȼ��ͨ������·�߿ɵ����ղ�Ʒ��
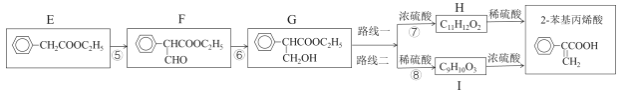
��2������F�Ƿ���ȫת��ΪG���Լ���___����Ӧ�ݵĻ�ѧ����ʽ��___��
��3��·�߶���·��һ��Ȳ�̫���룬������___��
��4����Ʋ��������ºϳ�����ͼ___��

���ϳ�·�߳��õı�ʾ��ʽΪ��A![]() B����
B����![]() Ŀ����
Ŀ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����15�֣�����ˮ������������SMR���Ǵ�ͳ��ȡ������������Ҫ���������й��ռ��ɱ��͵��ŵ㡣
�ش��������⣺
��1����֪1000 Kʱ�����з�Ӧ��ƽ�ⳣ���ͷ�Ӧ�ȣ�
��CH4(g)![]() C(s)+2H2(g) K1=10.2 ��H1
C(s)+2H2(g) K1=10.2 ��H1
��2CO(g)![]() C(s)+CO2(g) K2=0.6 ��H2
C(s)+CO2(g) K2=0.6 ��H2
��CO(g)+H2O(g)![]() CO2(g)+H2(g) K3=1.4 ��H3
CO2(g)+H2(g) K3=1.4 ��H3
��CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) K4 ��H4��SMR��
CO2(g)+4H2(g) K4 ��H4��SMR��
��1000 Kʱ��K4=____________����H4=_________������H1����H2����H3����ʾ����
��2���ڽ��������װ��ǰ����Ҫ��ԭ�����������������ʹ��Ũ��Ϊ0.5 ppm���¡������Ŀ��Ϊ______________��
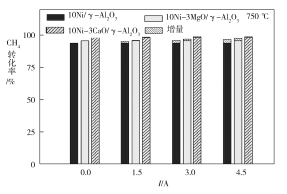
��3����ͼΪ��ͬ�¶������µ���ǿ�ȶ�CH4ת���ʵ�Ӱ�졣��ͼ��֪�������Բ�ͬ��������ͬ�¶������µļ���ˮ������������Ӧ�����Ŵٽ����ã������֪��H4____0������>������<������

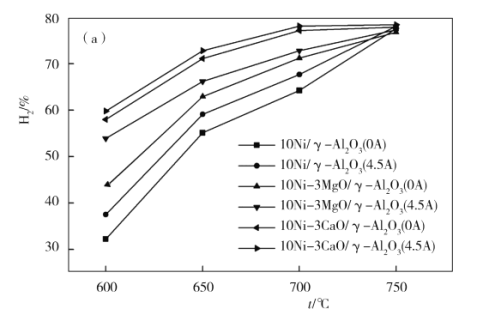
��4����ͼΪ��ͬ�¶�������6Сʱ�ȶ����Ե���ǿ�ȶ�H2���ʵ�Ӱ�졣��ͼ��֪�������¶ȵĽ��ͣ�������H2���ʵ�Ӱ��������____________����������������С����������������600 ��ʱ�����������ִ����е�____________����ͼ�еĴ�����ʾʽ�ش�Ӱ��Ч����Ϊ���������¶ȸ���750 ��ʱ�����۵���ǿ�ȴ�С����������H2����������ͬ����ԭ����______________��
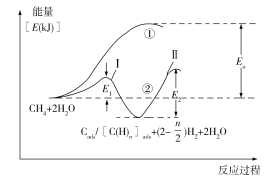
��5���ҹ���ѧ�ҶԼ����ˮ������������Ӧ����Ҳ�����˹㷺�о���ͨ����Ϊ�÷�Ӧ���������С���һ����CH4���ѽ�����H2��̼����̼�����֣�������̼����̼�����֣������ڴ����ϣ���CH4��Cads/[C(H)n]ads+(2�C![]() )H2���ڶ�����̼����̼�����֣���H2O��Ӧ����CO2��H2����Cads/[C(H)n]ads +2H2O��CO2 +(2+
)H2���ڶ�����̼����̼�����֣���H2O��Ӧ����CO2��H2����Cads/[C(H)n]ads +2H2O��CO2 +(2+![]() )H2����Ӧ���̺������仯��ͼ���£����̢�û�мӴ��������̢ڼ�������������̢ٺ͢���H�Ĺ�ϵΪ����_______�ڣ��������������������������������������̢ڷ�Ӧ���ʵ��ǵ�_______������ԭ��Ϊ____________________________��
)H2����Ӧ���̺������仯��ͼ���£����̢�û�мӴ��������̢ڼ�������������̢ٺ͢���H�Ĺ�ϵΪ����_______�ڣ��������������������������������������̢ڷ�Ӧ���ʵ��ǵ�_______������ԭ��Ϊ____________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��SCR��NSR��������Ч���Ͳ��ͷ������ڿ������������µ�NOx�ŷš�
��1��SCR��ѡ���Դ���ԭ������ԭ����
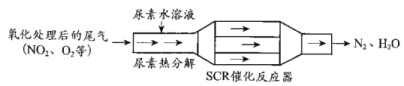
������ˮ��Һ�ȷֽ�ΪNH3��CO2���÷�Ӧ�Ļ�ѧ����ʽ��___��
�ڷ�Ӧ����NH3��ԭNO2�Ļ�ѧ����ʽ��___��
�۵�ȼ���к������ϸ�ʱ��β����SO2��O2�����»��γ�(NH4)2SO4��ʹ�����ж����û�ѧ����ʽ��ʾ(NH4)2SO4���γɣ�__��
��������ҺŨ��Ӱ��NO2��ת�����ⶨ��Һ�����أ�M=60g��mol-1�������ķ������£�ȡag������Һ������������ȫת��ΪNH3������NH3�ù�����v1mLc1mol��L-1H2SO4��Һ������ȫ��ʣ��H2SO4��v2mLc2mol��L-1NaOH��Һǡ���кͣ���������Һ�����ʵ�����������__��
��2��NSR��NOx���滹ԭ������ԭ����
NOx�Ĵ���ͻ�ԭ�ڲ�ͬʱ�ν�����У���ͼa��ʾ��
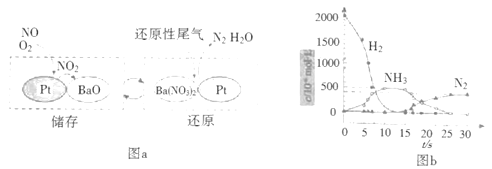
��ͨ��BaO��Ba(NO3)2���ת��ʵ��NOx�Ĵ���ͻ�ԭ������NOx��������__��
����H2ģ��β���л�ԭ�������о���Ba(NO3)2�Ĵ���ԭ���̣��ù��̷��������У�ͼb��ʾ�ù����������Ũ����ʱ��ı仯��ϵ����һ����Ӧ���ĵ�H2��Ba(NO3)2�����ʵ���֮����__��
�ۻ�ԭ�����У���ʱ�����Ц����N2O������ͬλ��ʾ�ٷ��о�����Ц���IJ�����NO�йء�������������15NO��NH3��һ��������Ӧʱ���õ���Ц����������15NNO�����÷�Ӧ�Ļ�ѧ����ʽ����������___![]() ��15NNO+��H2O___��
��15NNO+��H2O___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com