
【题目】(15分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。
回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g)![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g)![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) K4 ΔH4(SMR)
CO2(g)+4H2(g) K4 ΔH4(SMR)
则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
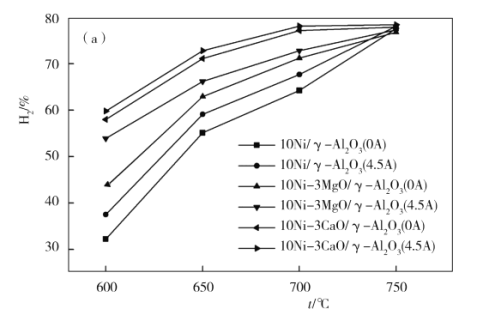
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。

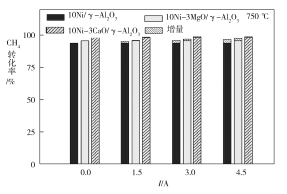
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。
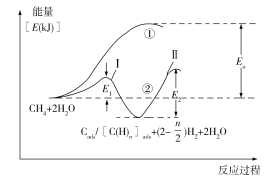
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
【答案】33.32 ΔH1+2ΔH3ΔH2 硫能使催化剂中毒(或硫能使催化剂活性下降等) > 增加 10Ni3MgO/γAl2O3 温度高于750 ℃时,几种情况下的反应均达到平衡,催化剂不改变平衡状态 = Ⅱ 第Ⅱ步的活化能大,反应速率慢
【解析】
(1)方程式CH4(g)+2H2O(g)![]() CO2(g)+4H2(g),是由方程式①+2×③②得到,K4=
CO2(g)+4H2(g),是由方程式①+2×③②得到,K4=![]() =
=![]() =33.32,ΔH4=ΔH1+2ΔH3ΔH2。
=33.32,ΔH4=ΔH1+2ΔH3ΔH2。
(2)硫会与催化剂反应,会使催化剂中毒,因此要脱硫。
(3)由图可知电流相同时,750 ℃甲烷的转化率比600 ℃时甲烷的转化率高,说明温度越高,转化率越高,K越大,ΔH4>0。
(4)据图可知,随温度降低,H2产率的变化幅度也增大,电流对H2产率的影响作用逐渐增加;600 ℃时,10Ni3MgO/γAl2O3催化剂在不同电流时H2产率的变化幅度最大,因此电流对10Ni3MgO/γAl2O3催化剂影响最为显著;测试时间为6小时,当温度高于750 ℃时,由于反应速率加快,反应已经达平衡移动,而催化剂不影响平衡移动,因此无论电流强度大小,有无催化剂,H2产率趋于相同。
(5)同一化学反应,催化剂只能改变反应的速率,对反应热不会造成影响,故过程①和②ΔH相等。根据活化能越大,反应速率就越慢,故控制整个反应速率的是活化能较高的步骤,即控速步骤为第Ⅱ步。


科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:

请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为一“铁链”图案,小明在图案上分别写了H2、CO2、Na2O、NaCl、FeCl3五种物质,图中相连的两种物质均可归属为一类,相交部分A、B、C、D为其相应的分类依据代号。请回答下列问题:

(1)请将分类依据代号填入相应的括号内:
(_____)两种物质都不是电解质
(_____)两种物质都是钠的化合物
(_____)两种物质都是氧化物
(_____)两种物质都是盐
(2)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴加入上图中某种物质M的饱和溶液,继续煮沸至溶液呈红褐色.
①物质M的化学式为___。
②证明有红褐色胶体生成的实验操作是__。
(3)以下A~D四个涉及H2O2的反应,请填空:
A.Na2O2+2HCl=H2O2+2NaCl
B.Ag2O+H2O2=2Ag+O2↑+H2O
C.2H2O2=2H2O+O2↑
D.![]() H2O2+
H2O2+![]() KMnO4+
KMnO4+![]() H2SO4→
H2SO4→![]() MnSO4+
MnSO4+![]() K2SO4+
K2SO4+![]() H2O+
H2O+![]() O2↑
O2↑
①配平D方程式,系数填在方框内__;该反应的还原剂是__;
②H2O2既体现氧化性,又体现还原性的反应是__,H2O2既不作氧化剂又不作还原剂的反应是__。(请用代号作答)
③请用双线桥法表示B反应中电子转移的方向和数目:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)物质的分离与提纯是化学的重点,请根据下列实验目的,分别选择相应的操作和实验装置。下列为操作:
a.蒸馏 b.结晶法 c.加适量水,过滤 d.加热(或灼烧) e.加适量盐酸,蒸发 f.萃取分液 g.分液 h.升华
下列为实验装置:
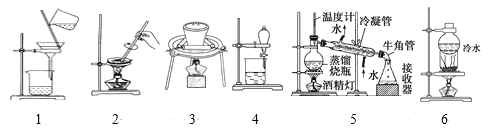
(1)从碘水中提取碘:___、__。(分别填操作序号及实验装置图编号,下同)。
(2)除去氧化钙中的碳酸钙:___、___。
(3)除去硫酸钡中的硝酸钾:___、___。
(4)分离固体细沙和碘的方法:___、___。
(5)除去氯化钠晶体中的碳酸钠:___、__。
(6)分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合液(两者互溶):__、_。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】掌握仪器名称、组装及使用方法是中学化学实验的基础。如图为实验室制取蒸馏水的实验装置。
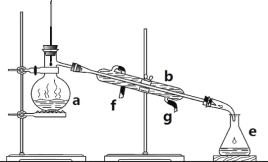
(1)写出下列仪器的名称:b.__;e___;
(2)若利用该装置分离四氯化碳和酒精的混合物,还缺少的仪器是___,将仪器补充完整后进行实验,温度计水银球的位置在___处。冷凝水由__(填f或g)口通入,另一口流出。仪器a___(填能或不能)直接加热。
(3)实验时a中除加入少量自来水外,还需加入少量__,其作用是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:![]()
![]()
![]() (R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
(R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
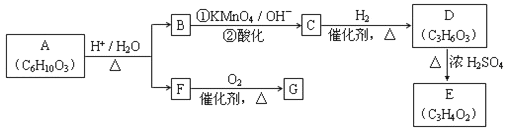
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1mol F与足量金属钠作用产生H2 22.4L(标准状况),则F的分子式是_____,名称是__________.
(2)G与F的相对分子质量之差为4,则G具有的性质是______(填字母)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________,该反应类型是_____反应
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_________.
(5)A转化为B和F的化学方程式是__________.
(6)A的同分异构体含有两种官能团,该化合物能发生水解,且1mol该化合物能与4mol银氨溶液反应,符合该条件的同分异构体一共有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Na、Na2O、Na2O2的混合物与足量的水反应,在标准状况下得到a L混合气体。将该混合气体通过电火花引燃,恰好完全反应,则原混合物中Na、Na2O、Na2O2的物质的量之比可能为
A. 2:1:1
B. 1:1:2
C. 1:2:1
D. 4:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫直接排放会危害环境。利用工业废碱渣(主要成分Na2CO3)可吸收烟气中的SO2并制备无水Na2SO3,其流程如图1。
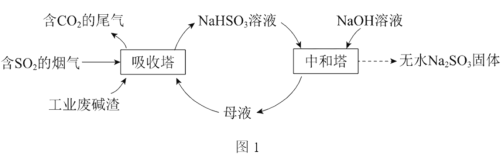
已知:H2SO3、HSO3、SO32在水溶液中的物质的量分数随pH的分布如图2,Na2SO3·7H2O和Na2SO3的溶解度曲线如图3。
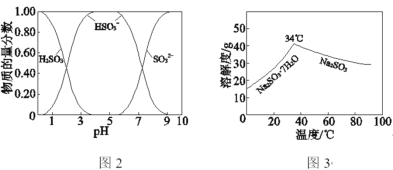
(1)Na2CO3溶液显碱性,用离子方程式解释其原因:_____________________。
(2)吸收烟气
①为提高NaHSO3的产率,应控制吸收塔中的pH为________。
②已知下列反应:
SO2(g)+2OH(aq)==SO32(aq)+H2O(l)ΔH1=164.3kJ·mol1
CO2(g)+2OH(aq)==CO32(aq)+H2O(l)ΔH2=109.4kJ·mol1
2HSO3(aq)==SO32(aq)+SO2(g)+H2O(l)ΔH3=+34.0kJ·mol1
吸收塔中Na2CO3溶液吸收SO2生成HSO3的热化学方程式是________。
③吸收塔中的温度不宜过高,可能的原因是________(写出1种即可)。
(3)制备无水Na2SO3
①中和塔中反应的离子方程式为_________________________________。
②从中和塔得到的Na2SO3溶液中要获得无水Na2SO3固体,需控制温度____________,同时还要_______________,以防止Na2SO3氧化。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L1NaOH溶液500 mL。
(1)在下图所示仪器中,配制上述溶液肯定不需要的是_________(填序号),除图中已有仪器外,还需要的玻璃仪器是________。
(2)根据计算用托盘天平称取的NaOH固体质量为__________g。
(3)关于容量瓶的四种叙述:
①是配制准确浓度溶液的仪器;②不宜贮存溶液;③不能用来加热;④使用之前要检查是否漏水。这些叙述中正确的是______(填字母)。
A.①②③④ B.②③ C.①②④ D.②③④
(4)容量瓶上需标有以下五项中的_________________(填序号)。
①温度 ②浓度 ③容量 ④压强 ⑤刻度线
(5)配制时,其正确的操作顺序是_________(用字母表示,每个操作只用一次)。
A.用少量水洗涤烧杯2次~3次,洗涤液均注入容量瓶,振荡
B.在盛有NaOH固体的烧杯中加入适量水溶解
C.将烧杯中已冷却的溶液沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,反复上下颠倒,摇匀
E.改用胶头滴管加水,使溶液凹液面恰好与刻度相切
F.继续往容量瓶内小心加水,直到液面接近刻度1 cm~2 cm处
(6)下列配制的溶液浓度偏低的是____________(填序号)。
A.称量NaOH时,砝码错放在左盘
B.向容量瓶中转移溶液时不慎有液滴洒在容量瓶外面
C.加蒸馏水时不慎超过了刻度线
D.定容时俯视刻度线
E.配制前,容量瓶中有少量蒸馏水
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com