
【题目】已知:![]()
![]()
![]() (R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
(R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
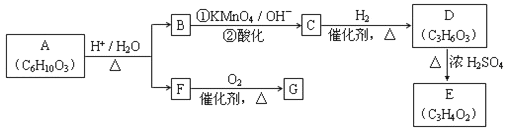
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1mol F与足量金属钠作用产生H2 22.4L(标准状况),则F的分子式是_____,名称是__________.
(2)G与F的相对分子质量之差为4,则G具有的性质是______(填字母)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________,该反应类型是_____反应
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_________.
(5)A转化为B和F的化学方程式是__________.
(6)A的同分异构体含有两种官能团,该化合物能发生水解,且1mol该化合物能与4mol银氨溶液反应,符合该条件的同分异构体一共有__________种。
【答案】C2H6O2 乙二醇 ac CH3CH(OH)COOH![]() CH2=CHCOOH+H2O 消去 CH2=CHCH2COOH、CH3CH=CHCOOH
CH2=CHCOOH+H2O 消去 CH2=CHCH2COOH、CH3CH=CHCOOH ![]() +H2O
+H2O![]()
![]() +HOCH2CH2OH 12
+HOCH2CH2OH 12
【解析】
F的蒸气密度是相同条件下H2密度的31倍,则其相对分子质量为62,1mol F与足量金属钠作用产生H222.4L(标准状况),即1molH2,说明F中很有2个-OH,应为乙二醇,即C2H6O2,被催化氧化生成醛,根据R-CH2OH→RCHO可知,二者相对分子质量相差2,G与F的相对分子质量之差为4,则G应为OHC-CHO,为乙二醛;A生成B和F的反应应为酯的水解,则B的分子式应为C4H6O2,结合题给信息可知应为![]() ,A为
,A为![]() ,C为
,C为![]() ,与氢气发生加成反应生成D,D应为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E,则E为CH2=CHCOOH,结合有机物的结构和性质解答该题。
,与氢气发生加成反应生成D,D应为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E,则E为CH2=CHCOOH,结合有机物的结构和性质解答该题。
(1)F的蒸气密度是相同条件下H2密度的31倍,则其相对分子质量为62,1mol F与足量金属钠作用产生H2 22.4L(标准状况),即1molH2,说明F中很有2个﹣OH,应为乙二醇,即C2H6O2;
故答案为:C2H6O2;乙二醇;
(2)G应为OHC﹣CHO,为乙二醛,含有﹣CHO,可发生氧化和加成反应,不能发生酯化反应,因含有2个﹣CHO,则1molG最多可与4mol新制Cu(OH)2发生反应;
故答案为:ac;
(3)D应为CH3CH(OH)COOH,CH3CH(OH)COOH在浓硫酸作用下发生消去反应生成E,则E为CH2=CHCOOH,反应的方程式为CH3CH(OH)COOH![]() CH2=CHCOOH+H2O;
CH2=CHCOOH+H2O;
(4)B为![]() ,H与B互为同分异构体,且所含官能团与B相同,可为CH2=CHCH2COOH、CH3CH=CHCOOH;
,H与B互为同分异构体,且所含官能团与B相同,可为CH2=CHCH2COOH、CH3CH=CHCOOH;
(5)A为![]() ,可水解生成
,可水解生成![]() 和乙二醇,反应的方程式为
和乙二醇,反应的方程式为![]() +H2O
+H2O![]()
![]() +HOCH2CH2OH;
+HOCH2CH2OH;
(6)A的同分异构体含有两种官能团,该化合物能发生水解,且1mol该化合物能与4mol银氨溶液反应,含有2个醛基,所以分子中不含醚键,只能为一个醛基一个甲酸酯基,共有12种结构。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
【题目】科学家刚刚发现了某种元素的原子,1个该原子质量是a g,一个12C的原子质量是b g,NA是阿伏加德罗常数的值,下列说法正确的是( )
①该原子的相对原子质量为![]() ②m g该原子的物质的量为
②m g该原子的物质的量为![]() mol ③该原子的摩尔质量是a NA g ④W g该原子中含有
mol ③该原子的摩尔质量是a NA g ④W g该原子中含有![]() 个该原子⑤由已知信息可得:NA=
个该原子⑤由已知信息可得:NA=![]()
A.①③⑤B.②③④C.①②⑤D.①②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W四种元素,X基态原子的最外层电子数是其内层电子数的2倍,Y基态原子的2p原子轨道上有3个未成对电子,Z是地壳中含量最多的元素,W的原子序数为24。
(1)W基态原子的核外电子排布式为___________,元素X、Y、Z的第一电离能由大到小的顺序为___________(用元素符号表达);
(2)与XYZ-互为等电子体的化学式为___________;
(3)1molHYZ3分子中含有σ键的数目为___________;
(4)YH3极易溶于水的主要原因是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾在氧气中燃烧时得到一种钾的氧化物晶体其结构如图所示,下列有关说法正确的是
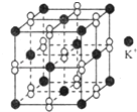
A.该氧化物属于离子晶体,其中只含离子键
B.1mol该晶体中含有的离子数目为3NA
C.晶体中与每个K+距离相等且最近的K+共有8个
D.晶体中每个K+同时吸引着6个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(15分)甲烷水蒸气催化重整(SMR)是传统制取富氢混合气的重要方法,具有工艺简单、成本低等优点。
回答下列问题:
(1)已知1000 K时,下列反应的平衡常数和反应热:
①CH4(g)![]() C(s)+2H2(g) K1=10.2 ΔH1
C(s)+2H2(g) K1=10.2 ΔH1
②2CO(g)![]() C(s)+CO2(g) K2=0.6 ΔH2
C(s)+CO2(g) K2=0.6 ΔH2
③CO(g)+H2O(g)![]() CO2(g)+H2(g) K3=1.4 ΔH3
CO2(g)+H2(g) K3=1.4 ΔH3
④CH4(g)+2H2O(g)![]() CO2(g)+4H2(g) K4 ΔH4(SMR)
CO2(g)+4H2(g) K4 ΔH4(SMR)
则1000 K时,K4=____________;ΔH4=_________(用ΔH1、ΔH2、ΔH3来表示)。
(2)在进入催化重整装置前,先要对原料气进行脱硫操作,使其浓度为0.5 ppm以下。脱硫的目的为______________。
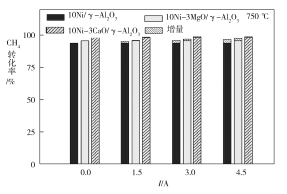
(3)下图为不同温度条件下电流强度对CH4转化率的影响。由图可知,电流对不同催化剂、不同温度条件下的甲烷水蒸气催化重整反应均有着促进作用,则可推知ΔH4____0(填“>”或“<”)。

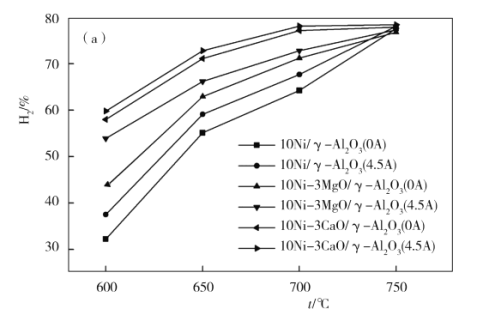
(4)下图为不同温度条件下6小时稳定测试电流强度对H2产率的影响。由图可知,随着温度的降低,电流对H2产率的影响作用逐渐____________(填“增加”“减小”或“不变”),600 ℃时,电流对三种催化剂中的____________(用图中的催化剂表示式回答)影响效果最为显著,当温度高于750 ℃时,无论电流强度大小,有无催化剂,H2产率趋于相同,其原因是______________。
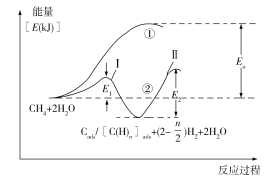
(5)我国科学家对甲烷和水蒸气催化重整反应机理也进行了广泛研究,通常认为该反应分两步进行。第一步:CH4催化裂解生成H2和碳(或碳氢物种),其中碳(或碳氢物种)吸附在催化剂上,如CH4→Cads/[C(H)n]ads+(2–![]() )H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+
)H2;第二步:碳(或碳氢物种)和H2O反应生成CO2和H2,如Cads/[C(H)n]ads +2H2O→CO2 +(2+![]() )H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
)H2。反应过程和能量变化残图如下(过程①没有加催化剂,过程②加入催化剂),过程①和②ΔH的关系为:①_______②(填“>”“<”或“=”);控制整个过程②反应速率的是第_______步,其原因为____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属的混合物3g投入盐酸中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
A.Mg和AlB.K和CaC.Na和CuD.K和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是( )
A.铁与水蒸气在高温下反应:2Fe+3H2O![]() Fe2O3+3H2
Fe2O3+3H2
B.Na投入水中:Na+H2O=Na++OH-+H2↑
C.氢氧化铁胶体的制备Fe3++3H2O=Fe(OH)3↓+3H+
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
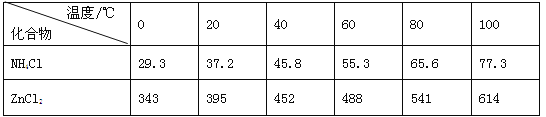
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com