
【题目】两种金属的混合物3g投入盐酸中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
A.Mg和AlB.K和CaC.Na和CuD.K和Na
【答案】A
【解析】
设金属和盐酸反应后都生成+2价金属氯化物,则氢气和金属的物质的量相等。即n(金属)=n(H2)=0.05mol,则金属的平均摩尔质量为![]() =60g/mol。若两种金属的摩尔质量(在数值上等于其相对原子质量)均大于60或小于60,则符合题意。若两种金属的相对原子质量一个大于60,另一个小于60,则不符合题意。
=60g/mol。若两种金属的摩尔质量(在数值上等于其相对原子质量)均大于60或小于60,则符合题意。若两种金属的相对原子质量一个大于60,另一个小于60,则不符合题意。
A.镁的相对原子质量为24,Al转化为+2价的相对原子质量为18,均小于60,故A选;
B.K的相对原子质量为39,转化为+2价为78,Ca的相对原子质量为40,故B不选;
C.Na的相对原子质量为23,转化为+2价为46,铜不和盐酸反应,故C不选;
D. K的相对原子质量为39,转化为+2价为78,Na的相对原子质量为23,转化为+2价为46,故D不选;
故选A。


科目:高中化学 来源: 题型:
【题目】青蒿素是烃的含氧衍生物,为无色针状晶体,易溶于丙酮、氯仿和苯中,在甲醇、乙醇、乙醚、石油醚中可溶解,在水中几乎不溶,熔点为156~157℃,热稳定性差,青蒿素是高效的抗疟药。已知:乙醚沸点为35℃。从青蒿中提取青蒿素的方法之一是以萃取原理为基础的,主要有乙醚浸取法和汽油浸取法。乙醚浸取法的主要工艺为:

请回答下列问题:
(1)对青蒿进行干燥破碎的目的是_______。
(2)操作I需要的玻璃仪器主要有:烧杯、玻璃棒、______,操作I、II的名称依次是抽滤、________。
(3)操作Ⅲ的主要过程可能是___________(填字母)。
A.加水溶解,蒸发浓缩、冷却结晶
B.加95%的乙醇,浓缩、结晶、过滤
C.加入乙醚进行萃取分液
(4)用下列实验装置测定青蒿素分子式的方法如下:将28.2g青蒿素样品放在硬质玻璃管C中,缓缓通入空气数分钟后,再充分燃烧,精确测定装置E和F实验前后的质量,根据所测数据计算。

①装置E中盛放的物质是___________,装置F中盛放的物质是____________。
a、浓硫酸 b、无水硫酸铜 c、无水CaCl2 d、碱石灰
②该实验装置可能会产生误差,造成测定含氧量偏低,改进方法是____________。
③用合理改进后的装置进行试验,称得:

则测得青蒿素的最简式是__________。
(5)某学生对青蒿素的性质进行探究。将青蒿素加入含有NaOH、酚酞的水溶液中,青蒿素的溶解量较小,加热并搅拌,青蒿素的溶解量增大,且溶液红色变浅,说明青蒿素与__________(填字母)具有相同的性质。
A.乙醇 B.乙酸 C.乙酸乙酯 D.葡萄糖
(6)某科研小组经多次提取青蒿素实验认为用石油醚做溶剂较为适宜,实验中通过控制其他实验条件不变,来研究原料的粒度、提取时间和提取温度对青蒿素提取速率的影响,其结果如下图所示:

由上图可知控制其他实验条件不变,采用的最佳粒度、时间和温度为_______________。
A. 80目、100分钟、50℃
B.60目、120分钟、50℃
C.60目、120分钟、55℃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了监测某烟道气中的NOx的含量,选用如下采样和检测方法。

I.采样步骤
①检验系统气密性;②加热器将烟道气加热至140℃;③打开抽气泵置换系统内空气;④采集无尘、干燥的气样;⑤关闭系统,停止采样。
(1)A中装有无碱玻璃棉,其作用是___。采样步骤②加热烟道气的目的是___。
C中填充的干燥剂最好的选择是___(选填编号)。
a.碱石灰 b.无水CuSO4 c.P2O5
(2)用实验室常用仪器组装一套装置,其作用与D(装有碱液)相同,在虚线框中画出该装置的示意图,标明气体的流向及试剂___。

Ⅱ.NOx含量的测定
将一定量的气样通入适量酸化的H2O2溶液中,使NOx完全被氧化为NO3-,然后加入过量的FeSO4标准溶液,充分反应后,再用K2Cr2O7标准溶液滴定剩余的Fe2+。
(3)NO被H2O2氧化为NO3-的离子方程式是___。滴定操作使用的玻璃仪器主要有___。
(4)滴定过程中发生下列反应:3Fe2++NO3+4H+=NO↑+3Fe3++2H2O、Cr2O72+6Fe2++14H+=2Cr3++6Fe3++7H2O。判断下列情况对NOx含量测定结果的影响(填“偏高”、“偏低”或“无影响”):若缺少采样步骤③,会使测试结果___;若FeSO4标准溶液部分变质,会使测定结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为除去粗盐中的CaCl2、MgCl2、硫酸钠以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下:
![]()
(1)第⑤步中,操作B是___(填操作名称),第④步中,试剂Y是___。
(2)判断试剂X过量的方法是___。
(3)写出第②步中涉及反应的化学方程式___。
(4)第⑤步操作中得到的固体成分有:泥沙、CaCO3、Mg(OH)2、___(填化学式)。
(5)此实验方案尚需完善,具体步骤是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
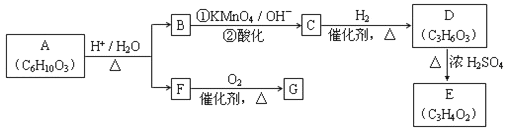
【题目】已知:![]()
![]()
![]() (R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
(R、R'可表示烃基或官能团)。A可发生如图转化(方框内物质均为有机物,部分无机产物已略去):
请回答:
(1)F的蒸气密度是相同条件下H2密度的31倍,且分子中无甲基。已知1mol F与足量金属钠作用产生H2 22.4L(标准状况),则F的分子式是_____,名称是__________.
(2)G与F的相对分子质量之差为4,则G具有的性质是______(填字母)
a.可与银氨溶液反应 b.可与乙酸发生酯化反应
c.可与氢气发生加成反应 d.1mol G最多可与2mol新制Cu(OH)2发生反应
(3)D能与NaHCO3溶液发生反应,且两分子D可以反应得到含有六元环的酯类化合物,E可使溴的四氯化碳溶液褪色,则D→E的化学方程式是______________,该反应类型是_____反应
(4)H与B互为同分异构体,且所含官能团与B相同,则H的结构简式可能是:_________.
(5)A转化为B和F的化学方程式是__________.
(6)A的同分异构体含有两种官能团,该化合物能发生水解,且1mol该化合物能与4mol银氨溶液反应,符合该条件的同分异构体一共有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有部分被氧化了的Fe-Cu合金样品(氧化产物Fe2O3、CuO)5.76g,经如下处理:

下列说法正确的是( )
A.滤液A中的阳离子Fe2+ 、Fe3+、H+B.样品Fe元素的质量为2.24g
C.样品CuO的质量4.0gD.V=336
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述中,正确的是( )

A.用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
B.利用装置③可制备氢氧化亚铁并长时间观察其颜色
C.装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,既是化合反应,又是氧化还原反应的是( )
A.铁和氯气反应:2Fe+3Cl2![]() 2FeC13
2FeC13
B.生石灰与水反应:CaO+H2O=Ca(OH)2
C.氯化钠溶液和浓硫酸混合加热:2NaCl+H2SO4(浓)![]() Na2SO4+2HCl↑
Na2SO4+2HCl↑
D.氯气通入溴化钠溶液:C12+2NaBr=2NaCl+Br2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴印染化学、电镀等方面应用广泛。工业上对制革工业污泥中(主要含有Cr3+、Fe3+、Fe2+、Al3+等)Cr元素的回收与再利用工艺如图:

已知:①Al(OH)3与Cr(OH)3性质相似。
②2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
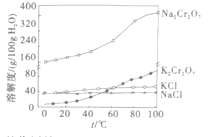
③有关物质的溶解度曲线如图。
回答下列问题:
(1)含铬污泥预处理包括高温煅烧粉碎等步骤,其中高温煅烧的目的是__(写一条即可),滤渣III的成分是__(填化学式)。
(2)步骤③中操作需要的玻璃仪器有__,步骤①加入H2O2的作用是__。
(3)步骤⑦反应能够发生的原因是__,写出步骤④的反应离子方程式:__。
(4)为测定产品中K2Cr2O7的含量,某兴趣小组将mg产品溶于水配制为500mL溶液,准确量取50.00mL,加入稀硫酸酸化,然后加入过量的KI充分还原,加___作指示剂,到达终点消耗30.00mL0.0500mol·L-1的Na2S2O3溶液。则该次生产的样品中K2Cr2O7含量为__%。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com