
����Ŀ�������������ĺ��������Ϊ��ɫ��״���壬�����ڱ�ͪ���ȷºͱ��У��ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��ˮ�м������ܣ��۵�Ϊ156��157�棬���ȶ��Բ�������Ǹ�Ч�Ŀ�űҩ����֪�����ѷе�Ϊ35�档����������ȡ�����صķ���֮һ������ȡԭ��Ϊ�����ģ���Ҫ�����ѽ�ȡ�������ͽ�ȡ�������ѽ�ȡ������Ҫ����Ϊ��

��ش��������⣺
��1����������и��������Ŀ����_______��
��2������I��Ҫ�IJ���������Ҫ�У��ձ�����������______������I��II�����������dz��ˡ�________��
��3�����������Ҫ���̿�����___________(����ĸ)��
A����ˮ�ܽ⣬����Ũ������ȴ�ᾧ
B����95�����Ҵ���Ũ�����ᾧ������
C���������ѽ�����ȡ��Һ
��4��������ʵ��װ�òⶨ�����ط���ʽ�ķ������£���28��2g��������Ʒ����Ӳ�ʲ�����C�У�����ͨ����������Ӻ��ٳ��ȼ�գ���ȷ�ⶨװ��E��Fʵ��ǰ��������������������ݼ��㡣

��װ��E��ʢ�ŵ�������___________��װ��F��ʢ�ŵ�������____________��
a��Ũ���� b����ˮ����ͭ c����ˮCaCl2 d����ʯ��
�ڸ�ʵ��װ�ÿ��ܻ��������ɲⶨ������ƫ�ͣ��Ľ�������____________��
���ú����Ľ����װ�ý������飬�Ƶã�

���������ص����ʽ��__________��
��5��ijѧ���������ص����ʽ���̽�����������ؼ��뺬��NaOH����̪��ˮ��Һ�У������ص��ܽ�����С�����Ȳ����裬�����ص��ܽ�����������Һ��ɫ��dz��˵����������__________(����ĸ)������ͬ�����ʡ�
A���Ҵ� B������ C���������� D��������
��6��ij����С�龭�����ȡ������ʵ����Ϊ��ʯ�������ܼ���Ϊ���ˣ�ʵ����ͨ����������ʵ���������䣬���о�ԭ�ϵ����ȡ���ȡʱ�����ȡ�¶ȶ���������ȡ���ʵ�Ӱ�죬��������ͼ��ʾ��

����ͼ��֪��������ʵ���������䣬���õ�������ȡ�ʱ����¶�Ϊ_______________��
A�� 80Ŀ��100���ӡ�50��
B��60Ŀ��120���ӡ�50��
C��60Ŀ��120���ӡ�55��
���𰸡��������������ѵĽӴ��������������صĽ�ȡ�� ©�� ���� B c d ��װ��F������һ����ֹ�����еĶ�����̼��ˮ��������F��װ�� C15H22O5 C B
��������
(1)����������ܼ��ĽӴ������������ܽ�����ʺͽ�ȡ�ʣ�
(2) ���˲�����Ҫ��ͨ�ձ���©���������������˺����Һ��������
(3)���������Ϣ�жϣ���ˮ�����ᴿ�����ʣ����������������ѣ��������ܽ����ʵ����ȡ��Һ�����Ҵ����ܽ⡢��Ũ�����ᾧ�����ˣ�ʵ���˷����ᴿ��
(4)U����ʢ�ŵ��ǹ��壬��ˮ�Ȼ���ֻ����ˮ�����ն�����̼������ˮ�ֵĶ�����̼���ü�ʯ�����գ���ʵ��װ�ò����������Ϊ�����е�ˮ�ֺͶ�����̼����Fװ���У�����������Ϣ�������Ʒ��̼���⡢��ԭ�ӵĸ����ȼ��ɵõ����������ʽ��
(5)������������Һ�м���ˮ�����������ʵ����ʡ�
(6)�ҳ�ͼ������ߵ��Ӧ���������ɵõ������ȡ��������
(1)�����������������������������������ѵĽӴ����������������صĽ�ȡ�ʣ�
(2)������ȡҺ�������ͨ����������ɣ����Բ���I����Ҫ�IJ���������©��������II�ڳ��˺�Ҫ�������Ѻ������صĻ��Һ���ʲ�������Ϊ����
(3) �����Ϣ��֪����������ˮ�м������ܣ��ų�A�
�����Ϣ��֪���������ڼ״����Ҵ������ѡ�ʯ�����п��ܽ⣬��95%���Ҵ���Ũ�����ᾧ�����˿��ᴿ�����أ�����ѡ��B�
���������������ܽ⣬�������Ѿ���ȡ��Һʵ���ᴿ���ų�C�
���������Ҫ���̿�����B��
(4) ��U����ʢ�ŵ��ǹ��壬װ��E��ʢ�ŵ���������H2O��ѡ����ˮ�Ȼ��ƣ�װ��F��ʢ�ŵ���������CO2��ѡ���ʯ�ң�
��װ��Fֱ��������Ӵ����������е�CO2��H2O��g������F�У�ʹ��õ�CO2������ƫ��ú�̼��ƫ�ߣ��ⶨ������ƫ�ͣ��������Ϊ��F������һ�����տ�����ˮ�������̼��װ�ã�
��Eװ�����ص�42.4g-22.6g=19.8gΪˮ�������ʵ���Ϊ19.8g��18g/mol=1.1mol��Fװ�����ص�146.2g-80.2g=66gΪ������̼�������ʵ���Ϊ66g��44g/mol=1.5mol���ɴ˿ɼ����28.2g����������ԭ�ӵ����ʵ���Ϊ(28.8g-1.5mol��12g/mol-1.1mol��2��1g/mol)��16g/mol=0.5mol��̼���⡢��ԭ�Ӹ�����Ϊ1.5mol����1.1mol��2��:0.5mol=15��22��5���ɵó������ص����ʽΪC15H22O5��
(5)���Ⱥ��ܽ�����������Һ��ɫ��dz��˵����ҺpH���ͣ�������������������Һ�м���ˮ�⣬�����������������ƣ����Դ�ѡ��C�
(6)�۲�����ͼ���֪����ȡ����߶�Ӧ������Ϊ60Ŀ��120���ӡ�50�棬���Դ�ѡ��B�


 �ο�������ϵ�д�
�ο�������ϵ�д� ������ѧ��ʱ��ҵϵ�д�
������ѧ��ʱ��ҵϵ�д� ���������ʱ��ѵϵ�д�
���������ʱ��ѵϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ��ˮϵп���ӵ���ܷ�ӦʽΪxZn+Zn1-xMn2O4![]() ZnMn2O4.(0<x<1)������˵��������ǣ� ��
ZnMn2O4.(0<x<1)������˵��������ǣ� ��
A.���ʱ�������ĵ缫��ӦʽΪZn1-xMn2O4+xZn2++2xe-=ZnMn2O4
B.�ŵ�ʱ��Zn2+������Ǩ��
C.��ŵ������п���̵Ļ��ϼ۶������仯
D.�ŵ�ʱ��ÿת��1mole-������������32.5g
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Һ�п��ܺ���Na+��K+��NH4+��Mg2+��Fe2+��SO42����SO32����Cl����I����CO32���е������֣�������Ũ�ȶ���ȡ���ȡ����Һ�����й�ʵ�飬ʵ��������ͼ��ʾ��
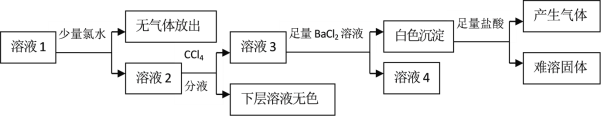
���й��ڸ���Һ��˵������ȷ����
A.ͨ��CCl4����ɫ������֪ԭ��Һ��һ��������I-
B.���ɫ�����м�������������岢�������ܹ������֪ԭ��Һ�д���SO32����CO32-
C.����Һ�в�����ͬʱ����NH4+��Cl-
D.��ȡ����Һ��������ŨNaOH��Һ�����ȣ����Թܿڵ�ʪ���ɫʯ����ֽ�����������ȷ��ԭ��Һ���������ӵĴ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʳ�����ճ�����ı���Ʒ��Ҳ����Ҫ�Ļ���ԭ�ϡ�
��1����ʳ���г���������K����Ca2����Mg2����Fe3����SO42-���������ӣ�ʵ�����ᴿNaCl���������£�

�ṩ���Լ�������Na2CO3��Һ������K2CO3��Һ��NaOH��Һ��BaCl2��Һ��Ba(NO3)2��Һ��75%�Ҵ������Ȼ�̼
������ȥ��Һ���е�Ca2����Mg2����Fe3����SO42-��ѡ��a���������Լ������μ�˳������Ϊ________(ֻ�ѧʽ)��
�ڷ�������������õ��IJ���������____________��
��ϴ�ӳ�ȥNaCl������渽��������KCl��ѡ�õ��Լ�Ϊ________��
��2�����ᴿ��NaCl����450 mL 4.00 mol��L��1NaCl��Һ������������ҩ�ס��ձ������������________(����������)��
��3����ʵ���ж���õ������������������������ֱ���______________��______________��______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�Ҹոշ�����ij��Ԫ�ص�ԭ�ӣ�1����ԭ��������a g��һ��12C��ԭ��������b g��NA�ǰ����ӵ�������ֵ������˵����ȷ���ǣ� ��
�ٸ�ԭ�ӵ����ԭ������Ϊ![]() �� ��m g��ԭ�ӵ����ʵ���Ϊ
�� ��m g��ԭ�ӵ����ʵ���Ϊ![]() mol���۸�ԭ�ӵ�Ħ��������a NA g�� ��W g��ԭ���к���
mol���۸�ԭ�ӵ�Ħ��������a NA g�� ��W g��ԭ���к���![]() ����ԭ�Ӣ�����֪��Ϣ�ɵã�NA=
����ԭ�Ӣ�����֪��Ϣ�ɵã�NA=![]()
A.�٢ۢ�B.�ڢۢ�C.�٢ڢ�D.�٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ӵ�������ֵΪ![]() ������˵����ȷ����
������˵����ȷ����
A. 1L0.1mol��![]() NH4Cl��Һ�У�
NH4Cl��Һ�У� ![]() ������Ϊ0.1
������Ϊ0.1![]()
B. 2.4gMg��H2SO4��ȫ��Ӧ��ת�Ƶĵ�����Ϊ0.1![]()
C. ��״���£�2.24LN2��O2�Ļ�������з�����Ϊ0.2![]()
D. 0.1mol H2��0.1mol I2���ܱ������г�ַ�Ӧ�����������Ϊ0.2![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҷ����������D������ʯ�����ѽ�õ���ϩ���ϳɡ��ش��������⣺

��1��B��AΪͬϵ�B�Ľṹ��ʽΪ_______��
��2����Ӧ���Ļ�ѧ����ʽΪ___________���䷴Ӧ����Ϊ__________��
��3����Ӧ���ķ�Ӧ����Ϊ____________��
��4��C�Ľṹ��ʽΪ___________��
��5����Ӧ���Ļ�ѧ����ʽΪ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ⶨCuSO4��xH2O�����xֵ���й����������������ʾ����֪x������ֵΪ5.0���������Ŀ���ԭ���ǣ� ��

A.�����к����ӷ�����B.����ʱ��ɫδ��ȫ���
C.û�з��ڸ���������ȴD.����ʱ�о��彦��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ֽ����Ļ����3gͶ�������У��ռ���1.12L��������״�����������ܹ��ɴ��ֻ������ǣ� ��
A.Mg��AlB.K��CaC.Na��CuD.K��Na
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com