
【题目】重铬酸钾(K2Cr2O7)在皮革、火柴印染化学、电镀等方面应用广泛。工业上对制革工业污泥中(主要含有Cr3+、Fe3+、Fe2+、Al3+等)Cr元素的回收与再利用工艺如图:

已知:①Al(OH)3与Cr(OH)3性质相似。
②2CrO42-+2H+![]() Cr2O72-+H2O。
Cr2O72-+H2O。
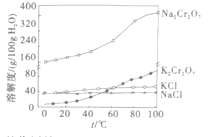
③有关物质的溶解度曲线如图。
回答下列问题:
(1)含铬污泥预处理包括高温煅烧粉碎等步骤,其中高温煅烧的目的是__(写一条即可),滤渣III的成分是__(填化学式)。
(2)步骤③中操作需要的玻璃仪器有__,步骤①加入H2O2的作用是__。
(3)步骤⑦反应能够发生的原因是__,写出步骤④的反应离子方程式:__。
(4)为测定产品中K2Cr2O7的含量,某兴趣小组将mg产品溶于水配制为500mL溶液,准确量取50.00mL,加入稀硫酸酸化,然后加入过量的KI充分还原,加___作指示剂,到达终点消耗30.00mL0.0500mol·L-1的Na2S2O3溶液。则该次生产的样品中K2Cr2O7含量为__%。(已知:Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O,2Na2S2O3+I2=Na2S4O6+2NaI)
【答案】除去蛋白质等有机物(改变污泥构造,便于酸浸等合理即可) Al(OH)3 烧杯、玻璃棒、漏斗 将Fe2+氧化成Fe3+ K2Cr2O7的溶解度小 3Cl2+2CrO2-+8OH-=2CrO42-+6Cl-+4H2O 淀粉溶液 ![]()
【解析】
硫酸浸取液中的金属离子主要是Cr3+,其次是Fe2+、Al3+和 Cu2+,加入过量氢氧化钠,Fe3+、 Cu2+生成沉淀,滤液的成分是NaAlO2和NaCrO2,通入氯气,NaCrO2 被氧化为Na2CrO4,通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,同时在酸性条件下,铬酸根转化为重铬酸根,即2CrO4-+2H+=Cr2O72-+H2O;然后析出重铬酸钠,溶解加入氯化钾可得重铬酸钾。
(1)从动物皮到皮革需要加入铬酸鞣制,因此制革厂含铬污泥含有蛋白质等有机质,高温煅烧可以除去蛋白质等有机质,同时改变污泥构造,便于溶解;根据流程,AlO2-溶液中通入过量CO2,会生成Al(OH)3,可得滤渣II的成分是Al(OH)3;
(2)经过步骤③得到滤液和滤渣Ⅱ,可知步骤③中操作为过滤,需要的玻璃仪器有烧杯、玻璃棒、漏斗;根据流程,步骤①加入双氧水,目的是将Fe2+氧化为Fe3+,便于除去;
(3)加入KCl的目的是使Na2Cr2O7转化为K2Cr2O7,根据信息,一定温度下,K2Cr2O7溶解度最小,故步骤⑦反应能够发生;由信息Al(OH)3与Cr(OH)3性质相似,根据流程,可知加入过量氢氧化钠,滤液的成分是NaAlO2和NaCrO2,通入氯气,NaCrO2被氧化为Na2CrO4,故离子方程式为3Cl2+2CrO2-+8OH-=2CrO42-+6Cl-+4H2O;
(4)有碘单质存在,可以选用淀粉溶液做指示剂;根据化学反应:Cr2O72-+6I-+14H+=2Cr3+3I2+7H2O和I2+2S2O32-=2I-+S4O62-,可得Cr2O72-~3I2~6S2O32-,ag产品最终消耗n(S2O32-)=0.0500mol/L×30.00×10-3L×![]() =0.0150mol,则n(Cr2O72-)=0.0150mol×
=0.0150mol,则n(Cr2O72-)=0.0150mol×![]() =0.00250mol,则样品中K2Cr2O7含量为
=0.00250mol,则样品中K2Cr2O7含量为![]() 。
。


科目:高中化学 来源: 题型:
【题目】两种金属的混合物3g投入盐酸中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
A.Mg和AlB.K和CaC.Na和CuD.K和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。

下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t ℃时,某平衡体系中含有X、Y、Z、W四种物质,此温度下发生反应的平衡常数表达式为K=![]() 。有关该平衡体系的说法正确的是
。有关该平衡体系的说法正确的是
A. 当混合气体的平均相对分子质量保持不变时,反应达平衡
B. 增大压强,各物质的浓度不变
C. 升高温度,平衡常数K增大
D. 增加X的量,平衡既可能正向移动,也可能逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
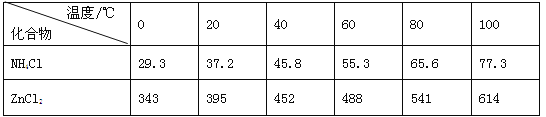
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据下表所示:
溶解度/(g/100g水)
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为___,电池反应的离子方程式为___。
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn___g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过___分离回收;滤渣的主要成分是MnO2、___和_______,欲从中得到较纯的MnO2,最简便的方法是___,其原理是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是某化学研究小组探究外界条件对化学反应速率和化学平衡影响的图像,其中图像和实验结论表达均正确的是( )


A. ①是其他条件一定时,反应速率随温度变化的图像,正反应ΔH<0
B. ②是在平衡体系的溶液中溶入少量KCl晶体后化学反应速率随时间变化的图像
C. ③是在有无催化剂存在下建立的平衡过程图像,a是使用催化剂时的曲线
D. ④是一定条件下,向含有一定量A的容器中逐渐加入B时的图像,压强p1>p2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是我国科学家研制的一种新型化学电池,成功实现了废气的处理和能源的利用(H2R和R都是有机物)。下列说法不正确的是( )
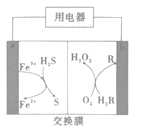
A.电池工作时,电子从电极b流出
B.负极区,发生反应2Fe3++H2S=2Fe2++S+2H+
C.电池工作时,负极区要保持呈酸性
D.电路中每通过2mol电子,理论上可处理标准状况下H2S22.4L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列解释事实的方程式不正确的是
A. 小苏打溶液呈弱碱性:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
B. 测0.1mol/L氨水的pH为11:NH3·H2O![]() NH4++OH-
NH4++OH-
C. pH=5的硫酸稀释1000倍,pH约等于7:H2O![]() H++OH-
H++OH-
D. 用Na2CO3处理水垢中CaSO4:CaSO4(s)+CO32-(aq)![]() SO42-(aq)+CaCO3(s)
SO42-(aq)+CaCO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向容积为2 L的密闭容器中充人2 mol A气体和1 mol B气体,在一定条件下发生如下反应:2A(g)+B(g) ![]() 3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
3C(g);经2 s后达到平衡,测得C气体的浓度为0.6 mol·L-1。下列说法中正确的是
①用物质A表示该反应的平均反应速率为0.2 mol·L-1·s-1
②用物质B表示该反应的平均反应速率为0.2 mol·L-1·s-1
③平衡时物质A与B的转化率相等
④平衡时物质B的浓度为0.2 mol·L-1
A. ①②③ B. ①③ C. ②④ D. ①④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com