
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。

下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
【答案】D
【解析】
由图象可知,pH=1.2时,c(H2A)=c(HA-),pH=2.7时,c(H2A)=c(A2-),pH=4.2时,c(HA-)=c(A2-),随着pH的增大,c(H2A)逐渐减小,c(HA-)先增大后减小,c(A2-)逐渐增大,结合电离平衡常数以及题给数据计算,可根据纵坐标比较浓度大小,以此解答该题。
A.由图象可知pH=1.2时,H2A与HA-的曲线相交,则c(H2A)=c(HA-),A正确;
B.pH=4.2时,c(H+)=10-4.2mol/L,c(HA-)=c(A2-),K2 (H2A)=![]() =10-4.2,则lg[K2(H2A)]=-4.2, B正确;
=10-4.2,则lg[K2(H2A)]=-4.2, B正确;
C.由图象可知,pH=2.7时,c(H2A)=c(A2-),由纵坐标数据可知c(HA-)>c (H2A)=c(A2-),C正确;
D.pH=4.2时,c(HA-)=c(A2-),但此时c (H2A)≈0,如体积不变,则c(HA-)=c(A2-)=0.05molL-1,c(H+)=10-4.2mol/L,如体积变化,则不能确定c(HA-)、c(A2-)与c(H+)浓度大小关系,D错误。
答案为D。


 开心蛙状元作业系列答案
开心蛙状元作业系列答案 课时掌控随堂练习系列答案
课时掌控随堂练习系列答案 一课一练一本通系列答案
一课一练一本通系列答案 浙江之星学业水平测试系列答案
浙江之星学业水平测试系列答案科目:高中化学 来源: 题型:
【题目】萜类化合物广泛存在于动植物体内。下列关于萜类化合物a、b的说法正确的是
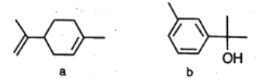
A.a中六元环上的一氯代物共有3种(不考虑立体异构)
B.a分子中所有原子都可能共平面,b的分子式为C10H12O
C.a和b都能发生加成反应、氧化反应、取代反应
D.1 mol b与足量的钠反应产生1 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
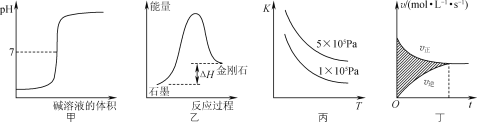
A. 图甲所示,表示强碱滴定强酸的滴定曲线
B. 图乙所示,从能量角度考虑,金刚石比石墨稳定
C. 图丙所示,表示反应2SO2(g)+O2(g)![]() 2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
2SO3(g);ΔH<0的平衡常数K与温度和压强的关系
D. 图丁所示,图中的阴影部分面积的含义是[υ(正)-υ(逆)]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于乙炔分子中的共价键说法正确的是
A. sp杂化轨道形成σ键属于极性键,未杂化的2p轨道形成π键属于非极性键
B. C-H之间是sp-s形成σ键,与s-p σ键的对称性不同
C. (CN)2与乙炔都属于直线型分子,所以(CN)2分子中含有3个σ键和2个π键
D. 由于π键的键能比σ键的键能小,乙炔分子![]() 三键的键能小于C-C单键的键能的3倍,所以乙炔化学性质活泼易于发生加成反应
三键的键能小于C-C单键的键能的3倍,所以乙炔化学性质活泼易于发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于杂化轨道的叙述中不正确的是
A. 分子中心原子通过sp3杂化轨道成键时该分子不一定为正四面体结构,所以杂化轨道理论与VSEPR模型分析分子的空间构型结果常常相互矛盾
B. 杂化轨道用于形成σ键或用于容纳未参与成键的孤电子对
C. SF2和C2H6分子中的中心原子S和C都是通过sp3杂化轨道成键
D. 苯分子中所有碳原子均采取sp2杂化成键,苯环中存在6个碳原子共有的大π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价,如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
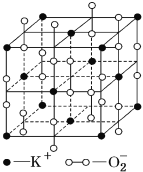
A. 超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个![]()
B. 晶体中每个K+周围有8个![]() ,每个
,每个![]() 周围有8个K+
周围有8个K+
C. 晶体中与每个K+距离最近的K+有8个,晶体中与每个![]() 距离最近的
距离最近的![]() 有6个
有6个
D. 晶体中其中0价氧和-2价氧的物质的量之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组设计如图所示的装置进行原电池原理的探究。下列叙述错误的是
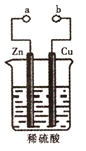
A. a和b不连接时,锌片上有气体生成,该装置不能形成原电池
B. a和b用导线连接时铜片为正极,发生的反应式为:2H++2e-=H2↑
C. a和b用导线连接时,电子由Zn经导线流向Cu,再经稀硫酸流回Zn
D. 无论a和b是否连接,稀硫酸均参与反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
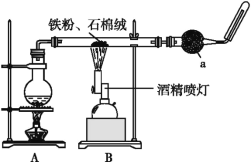
(1)已知该实验反应的反应方程式为:Fe+H2O![]() Fe3O4+H2(请配平)____。
Fe3O4+H2(请配平)____。
(2)仪器a的名称是________。
(3)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
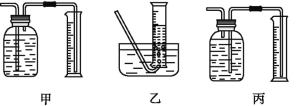
①该同学应该先点燃___(填“A”或“B”)处的酒精灯(或酒精喷灯),测量气体体积不可以选用上图中___(填“甲”“乙”或“丙”)装置。
②称取5.6 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为0.448 L,则铁粉的转化率为___。
(4)将硬质玻璃管中反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸溶解并过滤,为探究反应后溶液中可能的阳离子,小林同学进行如下实验,请你将下表补充完整:
步骤 | 现象 | 解释(用离子方程式表示) | 结论 |
Ⅰ.取样,滴加KSCN溶液 | 溶液不变红色 | ①Fe3O4+8H+=Fe2++2Fe3++4H2O ②____________ | Ⅲ.反应后的溶液中阳离子为_______ |
Ⅱ.取样,滴加NaOH溶液 | 刚开始无明显现象,一段时间后先出现白色沉淀,迅速变为灰绿色,最终变为红褐色 | ①____________ ②Fe2++2OH—=Fe(OH)2↓ ③4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是( )
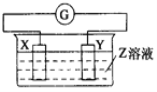
选项 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |
A.AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com