
【题目】关于下列各装置图的叙述中,正确的是( )

A.用如图装置进行实验,将装置①中的AlCl3滴入装置②浓氢氧化钠溶液中可观察到有大量白色沉淀产生
B.利用装置③可制备氢氧化亚铁并长时间观察其颜色
C.装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性
D.用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来说明金属铝的熔点较低
【答案】C
【解析】
A.AlCl3滴入过量的氢氧化钠中不会产生沉淀,而是生成NaAlO2,错误;
B.氢氧化亚铁容易被氧气氧化,所以用装置③制备的氢氧化亚铁会由白色迅速变成灰绿色,最后变成红褐色,错误;
C. NaHCO3不稳定,受热容易分解,产生的CO2能使石灰水变浑浊,Na2CO3稳定受热不分解。应该把NaHCO3装入小试管里才可以验证Na2CO3和NaHCO3两种固体的热稳定性,所以装置④不能验证Na2CO3和NaHCO3两种固体的热稳定性,正确;
D. 用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,由于铝容易被空气中的氧气氧化为熔点很高的氧化铝,所以熔化后的液态铝并不滴落,错误;
故选C。


科目:高中化学 来源: 题型:
【题目】乙二酸二乙酯(D)可由石油气裂解得到的烯烃合成。回答下列问题:

(1)B和A为同系物,B的结构简式为_______。
(2)反应①的化学方程式为___________,其反应类型为__________。
(3)反应③的反应类型为____________。
(4)C的结构简式为___________。
(5)反应②的化学方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钾在氧气中燃烧时得到一种钾的氧化物晶体其结构如图所示,下列有关说法正确的是
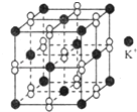
A.该氧化物属于离子晶体,其中只含离子键
B.1mol该晶体中含有的离子数目为3NA
C.晶体中与每个K+距离相等且最近的K+共有8个
D.晶体中每个K+同时吸引着6个阴离子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种金属的混合物3g投入盐酸中,收集到1.12L氢气(标准状况),不可能构成此种混合物的是( )
A.Mg和AlB.K和CaC.Na和CuD.K和Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式或化学方程式正确的是( )
A.铁与水蒸气在高温下反应:2Fe+3H2O![]() Fe2O3+3H2
Fe2O3+3H2
B.Na投入水中:Na+H2O=Na++OH-+H2↑
C.氢氧化铁胶体的制备Fe3++3H2O=Fe(OH)3↓+3H+
D.大理石溶于醋酸的反应:CaCO3+2CH3COOH=Ca2++2CH3COO-+H2O+CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由短周期元素组成的中学常见的含钠元素的物质A、B、C、D,存在如图转化关系(部分生成物和反应条件已略去)。

(1)若A为过氧化钠,A与CO2反应的化学方程式为___,A与水反应的离子方程式为___。
(2)①向饱和C溶液中通CO2,化学方程式为:___。
②1mol/L的B溶液逐滴加入1L1mol/L的AlCl3溶液中,产生白色沉淀39g,则所加入的B溶液的体积可能为___L。
(3)下列图象中,横坐标表示加入试剂或通入气体的物质的量,纵坐标表示产生沉淀的质量,用图象的序号或文字回答下列问题:

Ⅰ.表示向AlCl3溶液中逐渐滴加NaOH溶液的是___;
Ⅱ.表示向NaAlO2溶液中逐渐滴加稀盐酸的是___;
Ⅲ.表示向NaAlO2溶液中通入CO2的是___;
Ⅳ.③图___(填“能”或“不能”)代表向含NaOH的澄清石灰水中通入CO2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值为![]() 。下列说法正确的是
。下列说法正确的是
A. 1L0.1mol·![]() NH4Cl溶液中,
NH4Cl溶液中, ![]() 的数量为0.1
的数量为0.1![]()
B. 2.4gMg与H2SO4完全反应,转移的电子数为0.1![]()
C. 标准状况下,2.24LN2和O2的混合气体中分子数为0.2![]()
D. 0.1mol H2和0.1mol I2于密闭容器中充分反应后,其分子总数为0.2![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】改变0.1mol·L-1二元弱酸H2A溶液的pH,溶液中的H2A、HA-、A2-的物质的量分数φ(X)随pH的变化如图所示。

下列叙述错误的是( )
A.pH=1.2时,c(H2A)=c(HA-)
B.lg[K2(H2A)]=-4.2
C.pH=2.7时,c(HA-)>c(H2A)=c(A2-)
D.pH=4.2时,c(HA-)=c(A2-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是我国科学家研制的一种新型化学电池,成功实现了废气的处理和能源的利用(H2R和R都是有机物)。下列说法不正确的是( )
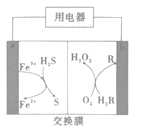
A.电池工作时,电子从电极b流出
B.负极区,发生反应2Fe3++H2S=2Fe2++S+2H+
C.电池工作时,负极区要保持呈酸性
D.电路中每通过2mol电子,理论上可处理标准状况下H2S22.4L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com