
����Ŀ��������Ҫ�Ľ������ϣ�������(��Ҫ�ɷ���Al2O3��������SiO2��Fe2O3����)�ǹ�ҵ����ȡ����ԭ�ϡ�ʵ����ģ�ҵ����������Ϊԭ����ȡAl2(SO4)3�����������[NH4Al(SO4)2��12H2O]�Ĺ���������ͼ��ʾ��

��ش��������⣺
��1������a�Ļ�ѧʽΪ________��
��2��д�����мӹ������ռ��漰���ķ�Ӧ���ӷ���ʽ______________��_____________������ͨ������CO2���巢����Ӧ�����ӷ���ʽΪ_________________��
��3�������еõ���Һc��ʵ�����Ϊ__________�����������Һ�л������������ʵ���������Ϊ(���������)________����ȴ�ᾧ������ϴ�ӡ�
��4����Һc��________�����ճ������г�����������________________����дһ������
��5����ͬʱ��ȡ���������������ͨ����������������������ֲ�Ʒ�IJ���������ʹ�Ƶõ�������������������ʵ���֮��Ϊ1��1����Ͷ��ʱ�������е�Al2O3��H2SO4�����ʵ���֮��Ϊ________��
���𰸡� SiO2 Al3+ + 4OH-=== AlO![]() +2H2O Fe3+ + 3OH- ===Fe(OH)3�� AlO
+2H2O Fe3+ + 3OH- ===Fe(OH)3�� AlO![]() ��CO2��2H2O===HCO
��CO2��2H2O===HCO![]() ��Al(OH)3�� ���� ����Ũ�� �� ���ͷۣ����������֣� 3��10
��Al(OH)3�� ���� ����Ũ�� �� ���ͷۣ����������֣� 3��10
�����������������������������Ϊԭ����ȡAl2��SO4��3��NH4Al��SO4��2��12H2O�Ĺ�������Ϊ���壬�������̵ķ���������ʽ����д�����ʵķ����ᴿ����ѧ���㡣��I��������ϡ�������������Al2O3��Fe2O3�ܽ�����AlCl3��FeCl3��SiO2����Ӧ��SiO2������ˮ������aΪSiO2����II��������Һ�м�������ռFeCl3��NaOH��Ӧ���ɺ��ɫ����Fe��OH��3��NaCl��AlCl3�����NaOH��Ӧ����NaCl��NaAlO2��H2O����III��������Һ��ͨ������CO2��CO2��NaAlO2��Һ��Ӧ����Al��OH��3��NaHCO3����IV����Al��OH��3���ȷֽ�����Al2O3��H2O����V����Al2O3������ϡ���ᷴӦ����Al2��SO4��3��H2O��Ȼ������Һ��ͨ��NH3�Ƶ��������Һ��
��1��������������������aΪ����������Ķ������裬����a�Ļ�ѧʽΪSiO2��
��2��II�м���������ռ��漰���ķ�Ӧ���ӷ���ʽΪAl3++4OH-=AlO2-+2H2O��Fe3++3OH-=Fe��OH��3����III��ͨ������CO2���巢����Ӧ�Ļ�ѧ����ʽΪCO2+NaAlO2+2H2O=Al��OH��3��+NaHCO3�����ӷ���ʽΪCO2+AlO2-+2H2O=Al��OH��3��+HCO3-��
��3��III�з�Ӧ�õ�������ˮ��Al��OH��3��NaHCO3��Һ���õ���Һc��ʵ�����Ϊ���ˡ����������Һ�л��NH4Al��SO4��2��12H2O��ʵ���������Ϊ����Ũ������ȴ�ᾧ������ϴ�ӡ�
��4����ҺcΪNaHCO3��Һ��NaHCO3��Һ�ʼ��ԡ��ճ������г���NaHCO3�����ͷ۵ȡ�
��5������������������ʵ���֮��Ϊ1:1����n��Al3+����n��SO42-��=3��5��Al3+ȫ�������������е�Al2O3��SO42-ȫ������H2SO4������Al��SO42-�غ���Ͷ��ʱ�������е�Al2O3��H2SO4���ʵ���֮��Ϊ![]() ��5=3��10��
��5=3��10��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ΪaL�������̼������Һ����̼������Һ�����������뽫��������̼������Һ�в��������������Ϊx��y��ͬ��ͬѹ����x������y������ԭ̼������������Һ�����ʵ����ʵ����ʵ���Ũ��֮��Ϊ�� ��
A. x ��y B. ��x-2y�� ��x C. 2x ����2x-y�� D. ��2x-y�� ��2x
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���йػ�ѧ��Ӧ��˵���У���ȷ���ǣ� ��
A.�Է���Ӧ���Ƿ��ȷ�Ӧ
B.�Է���Ӧ���������ӵķ�Ӧ
C.�Է���Ӧ���ǡ�G��0�ķ�Ӧ
D.�Է���Ӧ���ǡ�G��0�ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ��������Ʒ��������14.2 g�������4.48 L(��״����)���������Ħ��������
( )��
A. 28.4 B. 28.4 g/mol C. 71 D. 71 g/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��J���ת����ϵ����ͼ��ʾ��A��CΪ�������������AΪ����ɫ��ĩ��B��D�������г����������ʣ�F��J��������ˮ�İ�ɫ�����G��J���Ⱥ����ֽ�

��1��A�Ļ�ѧʽ��_________��A��B��Ӧ�ķ�Ӧ������________�����Ĵ������Ӧ���ͣ���
��2��I��J��Ӧ�����ӷ���ʽ��___________________________________________��
��3��Fת��ΪG�Ĺ����й۲쵽��������__________����Ӧ�Ļ�ѧ����ʽ��____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�������������
A. ���������B. ����������C. ������D. �˵����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ��������������ϵ���
A.��Ԫ��O2B.������C1��C.̼����NaCO3D.��AU
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и�������ʾ��ͼһ�µ��ǣ� ��
A.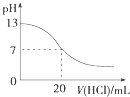
ͼ��ʾ25��ʱ����0.1 molL��1����ζ�20 mL 0.1 molL��1 NaOH��Һ����Һ��pH�����������ı仯
B.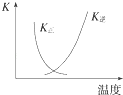 ͼ�����߱�ʾ��Ӧ2SO2��g��+O2��g��2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
ͼ�����߱�ʾ��Ӧ2SO2��g��+O2��g��2SO3��g����H��0�����淴Ӧ��ƽ�ⳣ��K���¶ȵı仯
C.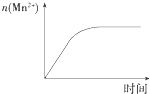
ͼ��ʾ10 mL 0.01 molL��1 KMnO4������Һ�������0.1 molL��1 H2C2O4��Һ���ʱ��n��Mn2+����ʱ��ı仯
D.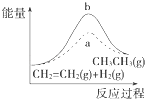
ͼ��a��b���߷ֱ��ʾ��ӦCH2�TCH2��g��+H2��g������CH3CH3��g����H��0ʹ�ú�δʹ�ô���ʱ����Ӧ�����е������仯
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£���̬���ӶϿ�1mol��ѧ�����ʱ��Ϊ���ܣ���֪H��H��H��O��O=O���ļ��ܡ�H�ֱ�Ϊ436kJ/mol��463kJ/mol��495kJ/mol��18gˮ�������Һ̬ˮ�ų�44kJ����������������ȼ����Ϊ�� ��
A.242.5kJmol��1
B.286.5kJmol��1
C.198.5kJmol��1
D.573kJmol��1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com