
【题目】下列各表述与示意图一致的是( )
A.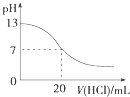
图表示25℃时,用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1 NaOH溶液,溶液的pH随加入酸体积的变化
B.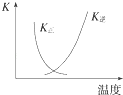 图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
图中曲线表示反应2SO2(g)+O2(g)2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化
C.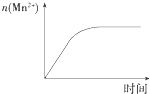
图表示10 mL 0.01 molL﹣1 KMnO4酸性溶液与过量的0.1 molL﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
D.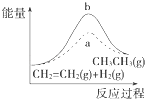
图中a、b曲线分别表示反应CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化
【答案】B
【解析】解:A.用0.1 molL﹣1盐酸滴定20 mL 0.1 molL﹣1NaOH溶液的pH随加入盐酸体积的变化,pH会突变,故A错误;
B.2SO2(g)+O2(g)2SO3(g)△H<0,升高温度平衡向吸热方向移动,即向逆方向移动,则逆方向是平衡常数增大,正方向的平衡常数减小,图象符合,故B正确;
C.反应中生成的Mn2+对该反应有催化作用,反应过程中溶液中锰离子浓度逐渐增大,所以反应速率先慢后快,图象不符合,故C错误;
D.CH2═CH2(g)+H2(g)﹣→CH3CH3(g)△H<0,属于放热反应,放热反应中反应物的总能量大于生成物的总能量,图象不符合,故D错误.
故选B.
【考点精析】通过灵活运用反应热和焓变和化学平衡状态本质及特征,掌握在化学反应中放出或吸收的热量,通常叫反应热;化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效)即可以解答此题.


科目:高中化学 来源: 题型:
【题目】(1)22克CO2的物质的量为_________mol,其中含有O原子的个数为_____________,含质子的物质的量为____mol,该气体在标准状况下的体积为_________L。
(2)写出下列反应的离子方程式。Fe2O3与稀盐酸反应_________________________________
(3)写出下列离子方程式对应的任意一个化学方程式。2H++CO32-![]() CO2↑+H2O __________________________________;
CO2↑+H2O __________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:

请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料经研磨烧结可合成一种高温超导物质Y2Ba4Cu6Ox,假设在研磨烧结过程中各元素的化合价无变化,则x的值为
A.12B.13C.15D.26
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液和100mL 0.5mol/L CaCl2溶液所含的Cl-物质的量浓度相同的是
A. 500mL 0.1mol/L MgCl2溶液 B. 100mL 0.5mol/L AlCl3溶液
C. 50mL 1mol/L NaCl溶液 D. 25mL 0.5mol/L HCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在空气中燃烧可以生成SO2 , SO2在催化剂作用下可以被氧化为SO3 , 其热化学方程式可表示为:S(g)+O2(g)═SO2(g)△H=﹣297kJ/mol,SO2(g)+ ![]() O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量.
O2(g)SO3(g);△H=﹣98.3kJ/mol.如图是上述两个反应过程与能量变化的关系图,其中Ⅰ表示0.4mol SO2(g)、1.6mol SO3(g)、0.2mol O2(g)具有的能量,Ⅲ表示64gS(g)与96g O2(g)所具有的能量. 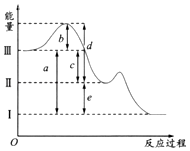
(1)Ⅰ→Ⅱ的反应是(填“吸热”,“放热”)反应.
(2)c为KJ.
(3)图示中b的大小对Ⅲ→Ⅱ反应的△H的影响是 .
A.△H随着b的增大而增大
B.△H随着b的增大而减小
C.△H随着b的减小而增大
D.△H不随b的变化而变化
(4)图中的d+e﹣b=KJ.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.原子晶体中只存在非极性共价键
B.干冰升华时,分子内共价键会发生断裂
C.由原子构成的晶体可以是原子晶体,也可以是分子晶体
D.只要含有金属阳离子的晶体就一定是离子晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2A(g)+B(g)3C(g)+4D(g)中,表示该反应速率最快的是( )
A.υ(A)=0.5mol/(Ls)
B.υ(B)=0.3mol/(Ls)
C.υ(C)=0.8mol/(Ls)
D.υ(D)=1mol/(Ls)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式的书写正确的是( )
A.水玻璃中通入过量二氧化碳:Na2SiO3+CO2+H2O═2Na++CO ![]() +H2SiO3
+H2SiO3
B.澄清石灰水中通入过量二氧化碳:Ca(OH)2+2CO2═Ca2++2HCO ![]()
C.硅与氢氟酸的反应:Si+4H++4F﹣═SiF4↑+2H2↑
D.二氧化硅溶于烧碱溶液中:SiO2+2OH﹣═SiO ![]() +H2O
+H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com