
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ��Ը���ʵ��ش�
��1��ȷ��ȡ4.1g�ռ���Ʒ��������Ҫ������ ��
��2������Ʒ���250mL����Һ����Ҫ�������� ��
��3��ȡ10.00mL����Һ���� ��ȡ��
��4����0.2010mol��L-1������ζ������ռ���Һ���ζ�ʱ ����ת��ʽ�ζ��ܵIJ��������� �ֲ�ͣ��ҡ����ƿ������ע�� ��ֱ���ζ��յ㡣
��5�������������ݣ���������ռ���Һ��Ũ��Ϊ�� ����Ʒ�ռ����������Ϊ________________��(�����ռ��в��������ᷴӦ������)
�ζ����� | ����Һ��� (mL) | ���������(mL) | |
�ζ�ǰ����(mL) | �ζ������(mL) | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 4.00 | 24.10 |
��6���ζ�����(��̪��ָʾ��),���������ʹ�ⶨ���ƫ�ߵ��� ��
����ʽ�ζ�����ˮϴ���װҺ����еζ�������ʽ�ζ���ˮϴ��������ȡ����Һ������ƿ������ˮϴ�Ӻ����ô���Һ��ϴ�����ζ������ϸ��������Һ������ƿ�ڶ���δҡ��ϴ�£��������ڵζ�ʱ������ƿ�⣻���μ����ᣬ��Һ��ɫ��ȥ�����������ָֻ���ɫ�����ζ�ǰ����ʽ�ζ��������ݣ��ζ�����ʧ������¼��ʼ���ʱ�����Ӷ������յ�ʱ���ӡ�
���𰸡���1����ƽ��С�ձ���ҩ��
��2��С�ձ�����������250 mL����ƿ����ͷ�ι�
��3����ʽ�ζ��ܻ���Һ��
��4����(1��)����(1��)����ƿ����Һ��ɫ�ı仯(1��)
��5��0.4020mol��L-1 (1��) 98.05%(1��)
��6���٢ۢݢ�
��������
�����������1�������������׳��⣬���к�ǿ�ĸ�ʴ�ԣ�����ʱӦ�÷���С�ձ��г��������Գ���ʹ�õ������У�������ƽ��ҩ�ס��ձ���
��2�����������г������ܽ⡢��Һ��ϴ�ӡ����ݡ�ҡ�ȵȲ�����һ����������ƽ��������ҩ��ȡ��ҩƷ�����ձ����ܽ⣬��ȴ��ת�Ƶ�250mL����ƿ�У����ò���������������ˮ��Һ�����̶���1��2cmʱ�����ý�ͷ�ιܵμӣ�������Ҫ�������ǣ�������ƽ��ҩ�ס��ձ�����������250mL����ƿ����ͷ�ιܣ�
��3������Һ�Ǽ�����Һ���ü�ʽ�ζ�����ȡ��
��4���ζ�ʱ���ζ�ʱ������ת�ζ��ܵIJ������������ֲ�ͣ��ҡ����ƿ������ע����ƿ����Һ��ɫ�ı仯���Ա�ȷ�ж��յ�ĵ��
��5���������ĵı�Һ������ֱ�Ϊ��19.90mL��20.10mL�����εζ����ݶ�����Ч�ģ��������ı�Һƽ�����Ϊ20.00mL������c(����)=![]() = [0.2010 mol/L �� 0.02L] �� 0.01L = 0.4020 molL-1������Ʒ���ռ�����ʵ���Ϊ��0.4020 molL-1 �� 0.25L = 0.1005mol�����ռ���Ʒ�Ĵ���Ϊ��0.1005mol �� 40 g/mol �� 4.1g �� 100% = 98.05%��
= [0.2010 mol/L �� 0.02L] �� 0.01L = 0.4020 molL-1������Ʒ���ռ�����ʵ���Ϊ��0.4020 molL-1 �� 0.25L = 0.1005mol�����ռ���Ʒ�Ĵ���Ϊ��0.1005mol �� 40 g/mol �� 4.1g �� 100% = 98.05%��
��6������ʽ�ζ�����ˮϴ���װҺ����еζ�����Һ��ϡ�ͣ������������ƫ������NaOH��ҺŨ��ƫ������ȷ������ʽ�ζ�����ˮϴ��������ȡ����Һ������Һ�����ʵ���ƫС�������������ƫС������NaOH��ҺŨ��ƫС��������������ƿ������ˮϴ�Ӻ����ô���Һ��ϴ������Һ�����ʵ���ƫ�������������ƫ������NaOH��ҺŨ��ƫ������ȷ�����ζ������ϸ��������Һ������ƿ�ڶ���δҡ��ϴ�£������������ƫС������NaOH��ҺŨ��ƫС�����������������ڵζ�ʱ������ƿ�⣬�����������ƫ������NaOH��ҺŨ��ƫ������ȷ�����μ����ᣬ��ɫ�������Ӽ���ɫ��δ��ȫ��Ӧ�������������ƫС������NaOH��ҺŨ��ƫС�������������ζ�ǰ����ʽ�ζ��������ݣ��ζ�����ʧ�������������ƫ������NaOH��ҺŨ��ƫ������ȷ������¼��ʼ���ʱ�����Ӷ������յ�ʱ���ӣ������������ƫС������NaOH��ҺŨ��ƫС���������ʴ�Ϊ�٢ۢݢ���



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
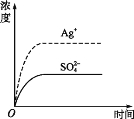
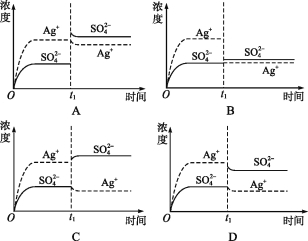
����Ŀ����֪Ag2SO4��Ksp Ϊ2.0��10-5,������Ag2SO4��������ˮ�����100 mL������Һ���ù�����Ag+��SO42��Ũ����ʱ��仯��ϵ��ͼ[����Ag2SO4��Һ��c(Ag+)=0.034 mol��L-1]����t1ʱ����������ϵ�м���100 mL 0.020 mol��L-1 Na2SO4 ��Һ,����ʾ��ͼ��,����ȷ��ʾt1ʱ�̺�Ag+��SO42��Ũ����ʱ��仯��ϵ����( )
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��
��1�����ѳ�����5.85gNaCl��������100mL 1.00mol/LNaCl��Һ�����������Ϊ_______________.
��2����9.5gij���۽������Ȼ����к���0.2molCl-�����Ȼ����Ħ������Ϊ___________���ý���Ԫ�ص����ԭ������Ϊ___________��
��3�����Ȼ���ACl3�У�AԪ������Ԫ�ص�������Ϊ1��3.94����A�����ԭ������Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����N2F2�����У�����ԭ�Ӿ�����8�����ȶ��ṹ����÷�����������ԭ��֮��ļ�������(����)
A. ����һ���Ҽ� B. ����һ���м�
C. һ���Ҽ���һ���м� D. һ���Ҽ��������м�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)����Ag2S(s)![]() 2Ag��(aq)��S2��(aq)����Ksp�ı���ʽΪ________��
2Ag��(aq)��S2��(aq)����Ksp�ı���ʽΪ________��
(2)����˵������ȷ����______________(�����)��
����ϡ����ϴ��AgCl��������ˮϴ�����AgCl��
��һ��أ����ʵ��ܽ�����¶ȵ����߶����ӣ������ʵ��ܽ��������ȵ�
�۶���Al(OH)3(s) ![]() Al(OH)3(aq)
Al(OH)3(aq) ![]() Al3����3OH����ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ��
Al3����3OH����ǰ��Ϊ�ܽ�ƽ�⣬����Ϊ����ƽ��
�ܳ�ȥ��Һ�е�Mg2������OH����������CO![]() �ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3�Ĵ�
�ã�˵��Mg(OH)2���ܽ�ȱ�MgCO3�Ĵ�
�ݳ�����Ӧ�г��ӹ����ij���������Ŀ����ʹ��������ȫ
(3)��γ�ȥMg(OH)2�л��е�Ca(OH)2��
___________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����в�����ϩ��;����
A�������� B�������� C�����л��ܼ� D������ʵ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���� 0.1 mol/L ������Һ�м�ˮϡ�ͣ����б仯����������ǣ� ��
A. ��Һ�� pH ������ B. ��Һ�е� c(OH��)��С
C. ����ĵ���̶������� D. ��Һ�ĵ���������С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���25��ʱijЩ�ε�Ũ�Ȼ�����������ĵ���ƽ�ⳣ��������˵����ȷ����( )
��ѧʽ | AgCl | Ag2CrO4 | CH3COOH | HClO | H2CO3 |
Ksp��Ka | Ksp=1.8��10-10 | Ksp=2.0��10-12 | Ka=1.8��10-5 | Ka=3.0��10-8 | Ka1=4.1��10-7 Ka2=5.6��10-11 |
A����ͬŨ��CH3COONa��NaClO�Ļ��Һ�У�������Ũ�ȵĴ�С��ϵ��
c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
B��̼������Һ�еμ�������ˮ�����ӷ���ʽH2O+2CO32-+Cl2=2HCO3-+Cl-+ClO-
C����0.1mol/LCH3COOH��Һ�еμ�NaOH��Һ��c(CH3COOH):c(CH3COO-)=9:5����ʱ��ҺpH=5
D����Ũ�Ⱦ�Ϊ1��10-3mol/L��KCl��K2CrO4���Һ�еμ�1��10-3mol/L��AgNO3��Һ��CrO42-���γɳ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ӦCH3OH(l)+NH3(g) = CH3NH2(g)+H2O(g)�ڸ��¶�ʱ�����Է����У���÷�Ӧ���̵ġ�H����S�ж���ȷ���ǣ� ��
A. ��H>0 ����S<0 B. ��H<0 ����S>0
C. ��H<0 ����S<0 D. ��H>0 ����S>0
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com