
【题目】2SO2(g)+O2(g)![]() 2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
2SO3(g)是工业制硫酸的主要反应之一。一定温度下,在甲、乙、丙、丁四个容器体积均为2 L的恒容密闭容器中投料,其起始物质的量及含硫反应物的平衡转化率如下表所示:
甲 | 乙 | 丙 | 丁 | ||
起始物质的量 | n(SO2)/mol | 0.40 | 0 | 0.80 | 0.02 |
n(O2)/mol | 0.24 | 0 | 0.48 | 0.04 | |
n(SO3)/mol | 0 | 0.40 | 0 | 0.40 | |
含硫反应物的平衡转化率% | 80 |
|
|
| |
下列判断中,正确的是
A. 该温度下,平衡常数的值为400 B. 平衡时,丙中c(SO3)是甲中的2倍
C. 平衡时,ɑ3>ɑ1 D. 乙中SO3的平衡转化率为ɑ1 = 20%
【答案】A
【解析】
A.甲中平衡时,二氧化硫的转化率为80%,则转化的二氧化硫为0.4mol×80%=0.32mol,则:
2SO2(g)+O2(g)2SO3(g)
起始量(mol):0.4 0.24 0
变化量(mol):0.32 0.16 0.32
平衡量(mol):0.08 0.08 0.32
平衡常数K=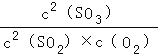 =
=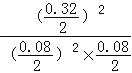 =400,故A正确;
=400,故A正确;
B.丙等效为在甲平衡的基础上压强增大一倍,平衡正向移动,丙中二氧化硫的转化率增大,平衡时丙中c(SO3)大于甲中的2倍,故B错误;
C.丁等效为在乙平衡的基础上在加入0.02molSO2、0.04molO2,平衡逆向移动,丁中二氧化硫转化率减小,即平衡时a3<a1,故C错误;
D.起始投入0.4molSO3与起始投入0.4molSO2、0.2molO2是完全等效平衡,乙等效为在甲到达平衡的基础上在移走0.04molO2,故乙平衡时三氧化硫的物质的量小于0.32mol,则乙中分解的三氧化硫大于0.4mol﹣0.32mol=0.08mol,则乙三氧化硫的转化率a1>![]() ×100%=20%,故D错误
×100%=20%,故D错误


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:
【题目】国际计量大会第26次会议新修订了阿伏加德罗常数(NA=6.02214076×1023mol-1),并于2019年5月20日正式生效。下列说法正确的是
A. 56g聚乙烯分子中含碳碳双键的数目为2 NA
B. 2 mol NH3和3molO2在催化剂和加热条件下充分反应生成NO的分子数为2 NA
C. 铅蓄电池放电时负极净增质量比正极净增质量多16g时转移电子数为NA
D. 1L0.5mlol·L-1Al2Fe(SO4)4溶液中阳离子数目小于1.5 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)6.02×1023个氢氧根离子的物质的量是________mol,其摩尔质量为________。
(2)在标准状况下,0.01 mol某气体的质量为0.44 g,则该气体的密度为________g·L1(保留小数点后两位),该气体的相对分子质量为________。
(3)在标准状况下,由CO和CO2组成的混合气体为6.72 L,质量为12 g,此混合物中CO和CO2物质的量之比是________,CO的体积分数是________,CO的质量分数是________,C和O原子个数比是________,混合气体的平均相对分子质量是________,密度是________g·L1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.氯气能用来制取漂白粉
B.利用钠的强还原性,可置换出CuCl2稀溶液中的金属Cu
C.MgO的熔点很高,可用耐高温材料
D.高纯硅用来制造电脑芯片
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有m g某气体,它由双原子分子构成,它的摩尔质量为M g/mol。若阿伏加德罗常数用NA表示,则:
(1)该气体所含原子总数为_________________个。
(2)该气体溶于1L水中(不考虑反应),其溶液中溶质的质量分数为____________。(水的密度为1g/mL)
(3)该气体溶于水后形成V L溶液,其溶液的物质的量浓度为_________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验基本操作不正确的是( )
A.容量瓶用蒸馏水洗涤后须烘干才能使用
B.可以用10 mL量筒量取8.0 mL稀硫酸
C.配制氯化铁溶液时,可将氯化铁溶解在较浓的盐酸中,然后再加水稀释
D.蒸馏操作时先通冷却水再加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.石油裂化、裂解和分馏均为化学变化
B.煤焦油中可以分离出苯、甲苯、二甲苯等有机化合物
C.利用CO2制造全降解塑料能有效减少环境污染
D.生物质能来源于植物及其加工产品所贮存的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
(1)水质优劣直接影响人体健康.天然水在净化处理过程中加入的混凝剂可以是 (填两种物质的名称),其净水作用的原理是
(2)水的净化与软化的区别是
(3)硬度为1°的水是指每升水含10mg CaO或与之相当的物质(如7.1mg MgO).若某天然水中c(Ca2+)=1.2×10﹣3mol/L,c(Mg2+)=6×10﹣4mol/L,则此水的硬度为 .
(4)若(3)中的天然水还含有c(HCO3﹣)=8×10﹣4mol/L,现要软化10m3这种天然水,则需先加入Ca(OH)2 克,后加入Na2CO3 克.
(5)如图是电渗析法淡化海水的原理图,其中,电极A接直流电源的正极,电极B接直流电源的负极.

①隔膜A是 (填“阴”或“阳”)离子交换膜;
②某种海水样品,经分析含有大量的Na+、Cl﹣,以及少量的K+、SO42﹣.若用上述装置对该海水进行淡化,当淡化工作完成后,A、B、C三室中所得溶液(或液体)的pH分别为pHa、pHb、pHc,则其大小顺序为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】298 K时,在20.0 mL 0.10 mol·L-1氨水中滴入0.10 mol·L-1的盐酸,溶液的pH与所加盐酸的体积关系如图所示。已知0.10 mol·L-1氨水的电离度为1.32%,下列有关叙述不正确的是( )

A. 该滴定过程应选择甲基橙作为指示剂
B. M点对应的盐酸体积小于20.0 mL
C. M点: c(NH4+)+ c(NH3·H2O) =c(Cl-)
D. M点处的溶液中c(NH4+)=c(Cl-)>c(H+)=c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com