
【题目】碘及其化合物在科研、生活等方面有广泛用途。回答下列问题:
(1)海带中富含碘,按如下实验流程可对海带中碘的含量进行测定。

取0.0100 mol/L的AgNO3标准溶液装入棕色滴定管,取100.00 mL海带浸取原液至滴定池,用电势滴定法测定碘含量。测得的电动势(E) 反映溶液中c(Iˉ)的变化,部分数据如下表:
V(AgNO3)/mL | 15.00 | 19.00 | 19.80 | 19.98 | 20.00 | 20.02 | 21.00 | 23.00 | 25.00 |
E/mV | -225 | -200 | -150 | -100 | 50.0 | 175 | 275 | 300 | 325 |
①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是____________ (填序号)。
a.烧杯 b.三脚架 c.温度计 d.泥三角 e.酒精灯 f.坩埚钳
②使用棕色滴定管的原因是_____________________。
③根据表中数据,计算海带中碘的百分含量为____________。
(2)“大象的牙膏”是著名化学实验之一,其实验方法是将浓缩的过氧化氢溶液与肥皂液混合,再滴加少量碘化钾溶液,即可观察到泡沫状物质像喷泉一样喷涌而出。
已知:2H2O2(l)=2H2O(l)+O2(g) △H=-196kJ/mol,活化能Ea=76kJ/mol,若用I-催化时活化能Ea’=57kJ/mol。
①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,请依次写出发生反应的离子方程式:
反应甲:______________________;
反应乙:______________________。
②反应甲为吸热反应,且甲的反应速率小于乙的反应速率,在下图中画出在H2O2溶液中加入KI后,反应过程的能量变化图。_______

(3)HI不稳定,其水溶液具有强酸性。现用0.lmol/LKI溶液、NH4I固体、pH试纸设计实验验证上述性质。简述实验方案。
①强酸性:__________________________。
②不稳定性:___________________________。
【答案】 bdef 防止硝酸银见光分解 0.508%或0.51% H2O2+I-=H2O+IO- H2O2+IO-=H2O+O2↑+I- 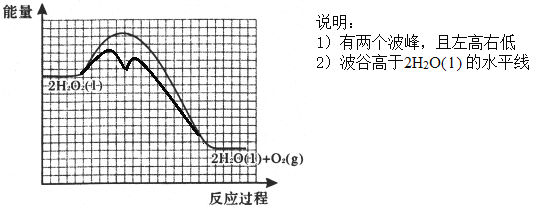 室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性 加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性
【解析】(1)①灼烧海带时,除需要坩埚外,还需要用到的实验仪器是三脚架、泥三角、酒精灯、坩埚钳,答案选 bdef;②防止硝酸银见光分解,所以使用棕色滴定管;③根据表中数据可知,当加入20mL硝酸银溶液时,电动势出现了突变,说明滴定终点时消耗了20.00mL硝酸银溶液;20.00mL硝酸银溶液中含有硝酸银的物质的量为:0.0100mol/L×0.02L=0.0002mol,则500mL原浸出液完全反应消耗硝酸银的物质的量为:0.0002mol×500mL/100mL=0.001mol,说明25.00g该海带中含有0.001mol碘离子,所以海带中碘的百分含量为:127g/mol×0.001mol/25.00g×100%=0.508%;(2)①在H2O2溶液中加入KI溶液作催化剂,反应过程中发生I-与IO-之间的转化,则第一步消耗碘离子,第二步又产生碘离子,依次发生反应的离子方程式为H2O2+I-=H2O+IO-、H2O2+IO-=H2O+O2↑+I-;②由于催化剂降低反应的活化能,但不能改变焓变。又因为反应甲为吸热反应,且甲的反应速率小于乙的反应速率,所以反应过程的能量变化图为 。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。
。(3)①如果HI是强酸,则KI不水解,溶液显碱性,因此证明是强酸的实验为:室温下,用pH试纸测得KI溶液的pH=7,证明HI溶液有强酸性;②如果HI不稳定,则受热分解生成碘蒸气,碘蒸气是紫色,则证明不稳定的实验为:加热NH4I固体,观察到有紫色蒸汽产生,证明HI具有不稳定性。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)可用作有机化学的氯化剂,在药物和染料的制取中也有重要作用。某化学学习小组拟用干燥的Cl2和SO2在活性炭催化下制取硫酰氯。反应的化学方程式为:SO2(g)+ Cl2(g) =SO2Cl2(l) ΔH =97.3 kJ·mol1,实验装置如图所示(部分夹持装置未画出)。

已知:硫酰氯通常条件下为无色液体,熔点54.1℃,沸点69.1℃。在潮湿空气中“发烟”;100°C以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。
回答下列问题:
(1)装置丙的冷凝管中冷凝水的入口是 (填“a”或“b”),装置己的作用是 ;如何控制两种反应物体积相等: 。
(2)装置戊上方分液漏斗中最好选用下列试剂: (选填字母)。
A.蒸馏水 B.饱和食盐水 C.浓氢氧化钠溶液 D.6.0 molL1盐酸
(3)若缺少装置乙和丁(均盛放浓硫酸),潮湿氯气和二氧化硫发生反应的化学方程式是 。
(4)氯磺酸(ClSO3H)加热分解,也能制得硫酰氯:2ClSO3H ==SO2Cl2 + H2SO4,分离两种产物的方法是______ (选填字母)。
A.重结晶 B.过滤 C.蒸馏 D.萃取
(5)长期储存的硫酰氯会发黄,可能的原因是 (用化学方程式和必要的文字加以解释)。
(6)若反应中消耗的氯气体积为896 mL(标准状况下),最后经过分离提纯得到4.05 g纯净的硫酰氯,则硫酰氯的产率为 。为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有 (写两条即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学平衡移动原理同样也适用于其他平衡,已知在氨水中存在下列平衡:NH3+H2O![]() NH3·H2O
NH3·H2O![]() NH4++OH-。
NH4++OH-。
(1)向氨水中加入MgCl2的固体时,平衡_________移动(填向左、向右或不),OH-的浓度________,(填变大、变小或不变,下同)NH4+的浓度_________。
(2)向氨水中加入浓盐酸,平衡__________移动(填向左、向右或不),此时溶液中浓度减小的微粒有________________。(至少填两种)
(3)向浓氨水中加入少量CaO固体,平衡___________移动(填向左、向右或不),此时发生的现象是______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质与用途有对应关系的是
A. Al2O3熔点高,可用作耐高温材料 B. NH4HCO3受热易分解,可用作氮肥
C. Fe2(SO4)3易溶于水,可用作净水剂 D. SO2具有氧化性,可用于漂白纸浆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】强酸与强碱的稀溶液发生中和反应的热效应为:H+(aq)+OH-(aq)=H2O(l)△H=-57.3KJ·mol-1。分别向1L 0.5mol·L-1的Ba(OH)2的溶液中加入①浓硫酸;②稀硝酸;③稀醋酸,恰好完全反应的热效应分别为△H1、△H2、△H3,下列关系正确的是
A. △H1>△H2>△H3
B. △H1>△H2=△H3
C. △H1<△H2<△H3
D. △H1=△H2<△H3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某分子的球棍模型如下图所示。已知分子中所有原子的最外层均达到8电子稳定结构,原子间以单键相连。下列有关说法中错误的是( )
![]()
A. X原子可能为第ⅤA族元素
B. Y原子一定为第ⅠA族元素
C. 该分子中既含有极性共价键又含有非极性共价键
D. 从圆球的大小分析,该分子可能为N2F4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,某些弱酸的电离平衡常数如下表。下列说法正确的是

A. 向漂白粉溶液中加入少量NaHSO3可增强漂白性
B. Na2CO3溶液中通入少量SO2发生反应的离子方程式为:2C032-+SO2+H2O=2HCO3-+S032-
C. 相同浓度的NaC1O、Na2CO3、NaHCO3溶液的pH值由大到小的顺序为:NaClO>Na2C03>NaHC03
D. 相同浓度的CH3COONa和NaClO溶液混合后,溶液中各离子浓度大小关系是:c(Na+)>c(ClO-)>c(CH3COO-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧乙酸(CH3COOOH)有强氧化性,用于物体表面、皮肤、果蔬、环境的消毒,其制备反应为:CH3COOH+H2O2![]() CH3COOOH+H2O,下列有关说法正确的是
CH3COOOH+H2O,下列有关说法正确的是
A. 增大压强可加快该反应速率
B. 加入合适的催化剂可改变该反应的反应热
C. 达到平衡时,用任意组分表示正逆反应速率都有v(正)=v(逆)
D. 达到平衡时,H2O2转化率为100%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数依次增大的X、Y、Z、Q、E五种元素中,X元素原子核外有三种不同的能级且各个能级所填充的电子数相同,Z是地壳内含量(质量分数)最高的元素,Q原子核外的M层中只有两对成对电子,E元素原子序数为29。
用元素符号或化学式回答下列问题:
(1)Y在周期表中的位置为__________________。
(2)已知YZ2+与XO2互为等电子体,则1mol YZ2+中含有π键数目为___________。
(3)X、Z与氢元素可形成化合物XH2Z,XH2Z分子中X的杂化方式为_________________。
(4)E原子的核外电子排布式为__________;E有可变价态,它的某价态的离子与Z的阴离子形成晶体的晶胞如图所示,该价态的化学式为____________。
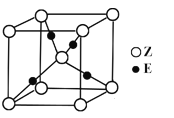
(5)氧元素和钠元素能够形成化合物F,其晶胞结构如图所示(立方体晶胞),晶体的密度为ρg··cm-3,列式计算晶胞的边长为a=______________cm(要求列代数式)。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com