
【题目】肼![]() 是一种无色、易溶于水的液体,沸点为
是一种无色、易溶于水的液体,沸点为![]() 。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用
。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解。广泛应用于医药等领域。实验室中用尿素法生产肼,并用![]() 吸收制备硫酸肼
吸收制备硫酸肼![]() 的装置如下:
的装置如下:
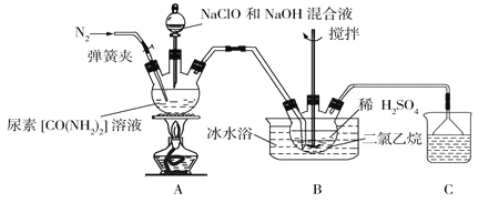
已知:①硫酸肼又称为“硫酸联氨”,是一种白色固体,微溶于冷水,易溶于热水,不溶于乙醇和二氯乙烷等有机溶剂,是一种类似于![]() 的盐类,有还原性。
的盐类,有还原性。
②密度:![]() 硫酸肼
硫酸肼![]() 二氯乙烷
二氯乙烷![]() 稀硫酸
稀硫酸![]() 。
。
回答下列问题:
(1)盛装尿素溶液的装置名称为__________________。
(2)反应前应先通入一段时间的氮气,其目的为________________________________。
(3)装置A中发生反应制备肼的离子方程式为__________________________________。
(4)反应过程中,如果分液漏斗中溶液滴速过快,会导致硫酸肼的产率偏低,其原因是_________。
(5)装置B中二氯乙烷的作用为_______________,使用冰水浴的作用为______________。
(6)装置B反应完全后需经过过滤、洗涤、干燥等操作得到硫酸肼,洗涤过程中最好选择下列哪种洗涤剂____________![]() 填字母
填字母![]() 。
。
A.冷水 ![]() 热水
热水 ![]() 无水乙醇
无水乙醇 ![]() 饱和食盐水
饱和食盐水
(7)硫酸肼还原![]() 制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上,
制银的方法既实现了废旧电池中Ag的回收利用,又不会对环境产生污染。理论上,![]() 硫酸肼可制得 ___________
硫酸肼可制得 ___________![]() 。
。
【答案】三颈烧瓶 赶走装置中的空气,避免空气与肼反应 ![]() 生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低 防倒吸,同时使产物硫酸肼从反应混合液析出 利于产物析出,同时降温防爆炸
生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低 防倒吸,同时使产物硫酸肼从反应混合液析出 利于产物析出,同时降温防爆炸 ![]()
![]()
【解析】
(1)盛装尿素溶液的装置名称为三颈烧瓶;
(2)肼![]() 是一种无色、易溶于水的液体,沸点为
是一种无色、易溶于水的液体,沸点为![]() 。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解,所以反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与肼反应;
。具有强还原性,长期暴露在空气中或短时间受高温作用会爆炸分解,所以反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与肼反应;
(3)装置A中,在碱性溶液中,ClO-将尿素氧化为肼,自身被还原为Cl-,发生氧化还原反应;
(4)如果分液漏斗中溶液滴速过快,会使过量的次氯酸钠氧化生成的肼;
(5)肼进入装置B中,由于二氯乙烷密度大于稀硫酸,所以二氯乙烷在稀硫酸的下层,肼直接通入二氯乙烷中,可以防止倒吸,同时硫酸肼不溶于二氯乙烷,可以使硫酸肼从反应混合液析出。二氯乙烷中通入肼后,肼逸出,在上层与稀硫酸反应生成硫酸肼,硫酸肼微溶于冷水,易溶于热水,冰水浴是为了降低产物的溶解性,同时降温防爆炸;
(6)洗涤过程中尽可能减少产品的溶解损失,由于硫酸肼不溶于乙醇,可选择无水乙醇;
(7)硫酸肼还原![]() 制银,利用得失电子守恒计算;
制银,利用得失电子守恒计算;
(1)盛装尿素溶液的装置名称为三颈烧瓶,故答案为:三颈烧瓶;
(2)反应前应先通入一段时间氮气,其目的为排尽装置内的空气,防止空气与强还原性的肼反应,故答案为:赶走装置中的空气,避免空气与肼反应;
(3)装置A中,在碱性溶液中,ClO-将尿素氧化为肼,自身被还原为Cl-,发生氧化还原反应:![]() ,
,
故答案为:![]() ;
;
(4)肼具有还原性,如果分液漏斗中溶液滴速过快,会使过量的次氯酸钠氧化生成的肼,故答案为:生成的肼被过量的次氯酸钠氧化,导致硫酸肼产率降低;
(5)装置B中二氯乙烷的作用为防倒吸,同时使产物硫酸肼脱离反应混合液,使用冰水浴的作用为减低产物的溶解度,同时降温防爆,故答案为:防倒吸;同时使产物硫酸肼从反应混合液析出,利于产物析出,同时降温防爆炸;
(6)装置B反应完全后经过滤,洗涤,干燥等操作得到硫酸肼,洗涤过程中尽可能减少产品的溶解损失,所以最好选择无水乙醇,故答案为C;
(7)硫酸肼还原![]() 制银,硫酸肼是还原剂,氧化银是氧化剂,银是还原产物,得到的物质无污染,故N2是氧化产物,1molN2H4·H2SO4中的+2价氮化合价升高为0价,失去4mol电子, Ag2O中的+1价银化合价降低到0价,生成1molAg得到1mol电子,根据电子守恒有:
制银,硫酸肼是还原剂,氧化银是氧化剂,银是还原产物,得到的物质无污染,故N2是氧化产物,1molN2H4·H2SO4中的+2价氮化合价升高为0价,失去4mol电子, Ag2O中的+1价银化合价降低到0价,生成1molAg得到1mol电子,根据电子守恒有:![]() =3323g;故答案为:3323;
=3323g;故答案为:3323;


科目:高中化学 来源: 题型:
【题目】2019年8月科学家在Science杂志首次报道了具有半导体特性的18个原子纯碳环分子(如图所示)。下列说法不正确的是
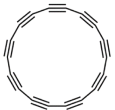
A.该分子属于有机物
B.该分子可能要比苯更加活泼
C.该分子所有的碳的杂化方式都是sp
D.该分子具有半导体的功能,可以使类似的直碳链成为分子级电子元件
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年诺贝尔化学奖颁给了三位为锂离子电池发展作出重要贡献的科学家。磷酸铁锂锂离子电池充电时阳极反应式为,![]() ,放电工作示意图如图。下列叙述不正确的是
,放电工作示意图如图。下列叙述不正确的是
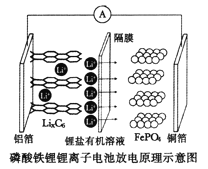
A.放电时,Li+通过隔膜移向正极
B.放电时,电子由铝箔沿导线流向铜箔
C.放电时正极反应为:![]()
D.磷酸铁锂锂离子电池充放电过程通过Li+迁移实现,C、Fe、P元素化合价均不发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示实验合理的是( )
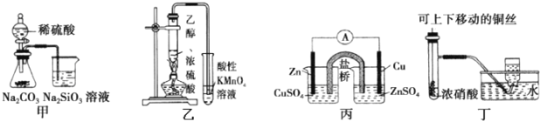
A.图甲证明非金属性强弱:S>C>Si
B.装置乙可用于检验有乙烯生成
C.图丙构成铜锌原电池,产生持续稳定的电流
D.图丁可制备并收集NO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,将3molSO2和1 molO2充入一定容密闭容器中,在催化剂存在下进行下列反应:2SO2(g)+ O2(g)![]() 2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
2SO3(g) △H=-197kJ/ mol,当达到平衡状态时,下列说法中正确的是
A.SO2与O2的转化率可能相等
B.容器中一定存在n(SO2)>1mol且n(SO3)<2mol
C.放出的热量为197kJ
D.当O2的转化率为50%时SO2和SO3 的物质的量一定相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国工程院院士李兰娟团队,于 2020 年 2 月 4 日公布治疗新冠病毒感染的肺炎最新研究成果。他们初步测试发现,在体外细胞实验中,阿比朵尔在 10~30 微摩尔浓度 下,与药物未处理的对照组比较,能有效抑制冠状病毒达 60 倍,并有显著抑制病毒对细 胞的病变效应。 因此“阿比朵尔”成为抗击新型冠状病毒潜在用药,其合成路线如下:
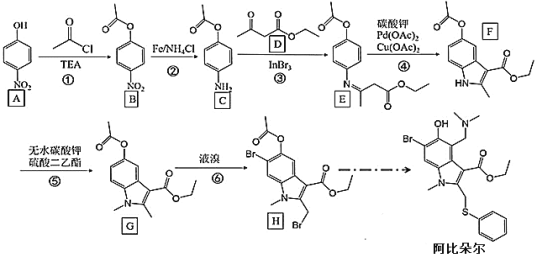
回答下列问题:
(1)有机物 A 的名称是____________。
(2)反应②、⑥反应类型分别是_________、______________。
(3)F 中含氧官能团的名称是_______________;G 的分子式为_______________。
(4)请写出反应③的化学反应方程式______________________________________。
(5)M 是 B 的一种同分异构体,满足下列条件的同分异构体有________种:①苯环上有3 个取代基;②能发生银镜反应;③能发生水解反应,且 1 mol M 水解消耗 4mol NaOH。其中核磁共振氢谱为有 4 组峰,峰面积之比为 2:2:2:1 的结构简式为_____。
(6)设计由甲苯和 2-丙醇为原料制备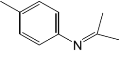 的合成路线_____。
的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列过程对应的离子方程式正确的是
A. NaHSO3溶于水呈酸性:NaHSO3=Na++H++SO32-
B. 在Na2S2O3溶液中滴加稀硫酸:2H++S2O32- = SO2↑+S↓+H2O
C. 浓盐酸与MnO2反应制氯气:MnO2+4HCl=Mn2++2Cl2+2H2O
D. 工业冶炼Mg:2Mg2++2O2-![]() 2Mg+O2↑
2Mg+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用Na2FeO4溶液氧化废水中的还原性污染物M,为研究降解效果,设计如下对比实验探究温度、浓度、 pH、催化剂对降解速率和效果的影响,实验测得M的浓度与时间关系如图所示:
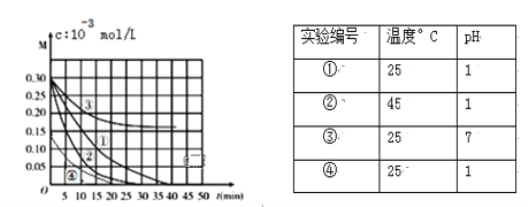
下列说法正确的是
A. 实验①在15 min内M的降解速率为1.33×10-2mol/(L·min)
B. 若其他条件相同,实验①②说明升高温度,M降解速率增大
C. 若其他条件相同,实验①③证明pH越高,越有利于M的降解
D. 实验②④说明M的浓度越小,降解的速率越慢
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
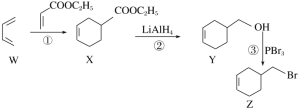
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com