
����Ŀ���й�����ԺԺʿ�������Ŷӣ��� 2020 �� 2 �� 4 �չ��������¹ڲ�����Ⱦ�ķ��������о��ɹ������dz������Է��֣�������ϸ��ʵ���У����ȶ���� 10~30 Ħ��Ũ�� �£���ҩ��δ�����Ķ�����Ƚϣ�����Ч���ƹ�״������ 60 ���������������Ʋ�����ϸ ���IJ���ЧӦ�� ��������ȶ������Ϊ��������״����DZ����ҩ����ϳ�·�����£�
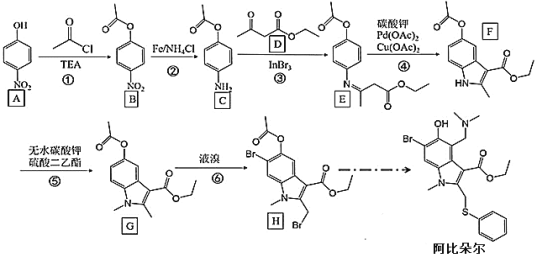
�ش��������⣺
��1����� A ��������____________��
��2����Ӧ�ڡ���Ӧ���ͷֱ���_________��______________��
��3��F �к��������ŵ�������_______________��G �ķ���ʽΪ_______________��
��4����д����Ӧ�۵Ļ�ѧ��Ӧ����ʽ______________________________________��
��5��M �� B ��һ��ͬ���칹�壬��������������ͬ���칹����________�֣��ٱ�������3 ��ȡ���������ܷ���������Ӧ�����ܷ���ˮ�ⷴӦ���� 1 mol M ˮ������ 4mol NaOH�����к˴Ź�������Ϊ�� 4 ��壬�����֮��Ϊ 2:2:2:1 �Ľṹ��ʽΪ_____��
��6������ɼױ��� 2-����Ϊԭ���Ʊ�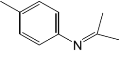 �ĺϳ�·��_____��
�ĺϳ�·��_____��
���𰸡����������ӻ� 4-�������� ��ԭ��Ӧ ȡ����Ӧ ���� C15H17NO4 ![]() 6
6 

��������
A����ȡ����Ӧ����B��B�������Ȼ�立�����ԭ��Ӧ����C��C��D������Ӧ�γ�̼��˫������E��E������Ӧ����F��F����ˮ̼��ء������������Ӧ����G��G����ȡ����Ӧ����H���ݴ�����
(1)�л���A�������Ƕ��������ӻ�4-�������ӣ��ʴ�Ϊ�����������ӻ�4-�������ӣ�
(2)��Ӧ����-NO2��Ϊ-NH2����Ӧ����Ϊ��ԭ��Ӧ����Ӧ���DZ����ϡ����Ϸ���ȡ�����ʴ�Ϊ����ԭ��Ӧ��ȡ����Ӧ��
(3)F�к��������ŵ�����������������G�Ľṹ��ʽ���õ�����ʽΪC15H17NO4���ʴ�Ϊ��������C15H17NO4��
(4)��Ӧ����-NH2��C=O������Ӧ�γ�̼��˫�����仯ѧ��Ӧ����ʽ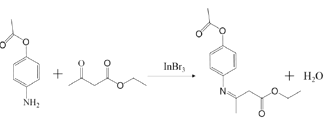 ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(5)M��B��һ��ͬ���칹�壬�ٱ�������3��ȡ���������ܷ���������Ӧ��˵����ȩ�������ܷ���ˮ�ⷴӦ��˵���з�������1 mol Mˮ������4mol NaOH����˵������������������������-OOCH����λ��-NH2�ڱ�������2�֣���������-OOCH�ڼ�λ��-NH2�ڱ�������3�֣���������-OOCH�ڶ�λ��-NH2�ڱ�������1�֣���������������ͬ���칹����6�֣����к˴Ź�������Ϊ��4��壬�����֮��Ϊ2:2:2:1�Ľṹ��ʽΪ ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��
(6)2-�����ڴ��������������ɱ�ͪ���ױ���Ũ���������������Ũ���ᷴӦ����![]() ��
��![]() ��Fe���Ȼ�������·�Ӧ����
��Fe���Ȼ�������·�Ӧ����![]() ��
��![]() ���ͪ��Ӧ����
���ͪ��Ӧ����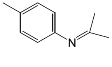 ����ϳ�·��Ϊ��
����ϳ�·��Ϊ�� ���ʴ�Ϊ��
���ʴ�Ϊ�� ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�������ֵ������˵����ȷ���ǣ� ��
A.40gNaOH�к��еĹ��õ��Ӷ���Ϊ2NA
B.���³�ѹ�£�1.8g��(��CD3)�к��е�������Ϊ0.9NA
C.31g����(![]() )���й��ۼ�������Ϊ6NA
)���й��ۼ�������Ϊ6NA
D.����£�22.4LH2O����������������ĿԼΪ2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������ϩͨ������95%���Ҵ���Ũ����![]() �����Ϊ1��3��ϼ��ȵ�170�淽���Ƶã����Ʊ�ԭ���ɱ�ʾ���£�CH3CH2OH+H2SO4(Ũ)
�����Ϊ1��3��ϼ��ȵ�170�淽���Ƶã����Ʊ�ԭ���ɱ�ʾ���£�CH3CH2OH+H2SO4(Ũ)![]() CH3CH2OSO2OH+H2O��
CH3CH2OSO2OH+H2O��
CH3CH2OSO2OH(Ũ)![]() CH2= CH2 + H2SO4��
CH2= CH2 + H2SO4��
(1)Ũ��������ϩ����������Ϊ ______ ����Ӧ������ ______ ��Ӧ����Ӧ������ ______ ��Ӧ��
(2)�˷���ʵ�ʲ���������ŨH2SO4�����������ݸߣ�������170������ʱ�䳤�����˽��Ҵ���ŨH2SO4�Ļ��Һ���ȵ�80��ʱ��һ����Ͷ��һЩС������ʯ�ң���������˷�Ӧ����ʱ�䣬�������ϩ�IJ��ʣ��������ʺ�ƽ�����۽���֮ ______
(3)��Ӧ�������Ҵ�����̿����ʹ��Һ�к�ɫ���ʳ��֣����ŷ�Ӧ����̿������Խ��Խ���أ�ͬʱ����ʹ�Ƶõ���ϩ�����к���CO2��SO2�����壬Ϊ�˼��ٷ�Ӧ������̿�������ֲ�Ӱ����ϩ�����ɣ����д�ʩ�������� ______ ��
A.�����Ҵ���Ũ����������Ϊ1��4
B.�����Ҵ���Ũ����������Ϊ1��2
C.�ô���ʯ�������Ƭ
D.���ͷ�Ӧ��ϵ�¶���140��
E.��������ˮ��(��P2O5)����Ũ����
(4)��ͼΪ�������ȷ�ϻ�������к�����ϩ�Ͷ��������ʵ��װ��ͼ��(�����Լ��ɹ�ѡ��Ʒ����Һ������������Һ����ˮ�����Ը������)
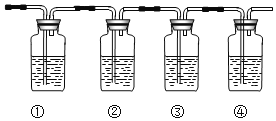
A.�٢ڢۢ��п�ʢ�ŵ��Լ��ֱ�Ϊ��______ �� ��______ ���� ______ �� �� ______ ��
B.��˵����������������ڵ������� ______ ��
C.��ȷ�Ϻ�����ϩ�������� ______ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaCl��һ�ֻ���ԭ�ϣ������Ʊ�һϵ�����ʣ���ͼ��ʾ������˵������ȷ���ǣ� ��
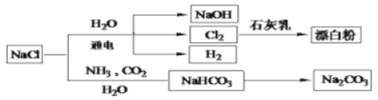
A.�Ե�ⱥ��ʳ��ˮΪ������ȡ�����Ȳ�Ʒ�Ĺ�ҵ��Ϊ�ȼҵ
B.��ʯ������Cl2��ȡ��Ư�۵���Ч�ɷ���Ca(ClO)2
C.Cl2��������Ӧ�����Һ�ȿɴ����ڸ�ƿ��
D.�����Ƽʵ���˴�NaCl��Na2CO3��ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����![]() ��һ����ɫ��������ˮ��Һ�壬�е�Ϊ
��һ����ɫ��������ˮ��Һ�壬�е�Ϊ![]() ������ǿ��ԭ�ԣ����ڱ�¶�ڿ����л��ʱ���ܸ������ûᱬը�ֽ⡣�㷺Ӧ����ҽҩ������ʵ�����������ط������£�����
������ǿ��ԭ�ԣ����ڱ�¶�ڿ����л��ʱ���ܸ������ûᱬը�ֽ⡣�㷺Ӧ����ҽҩ������ʵ�����������ط������£�����![]() �����Ʊ�������
�����Ʊ�������![]() ��װ�����£�
��װ�����£�
��֪�����������ֳ�Ϊ����������������һ�ְ�ɫ���壬������ˮ����������ˮ���������Ҵ��Ͷ���������л��ܼ�����һ��������![]() �����࣬�л�ԭ�ԡ�
�����࣬�л�ԭ�ԡ�
���ܶȣ�![]() ������
������![]() ��������
��������![]() ϡ����
ϡ����![]() ��
��
�ش��������⣺
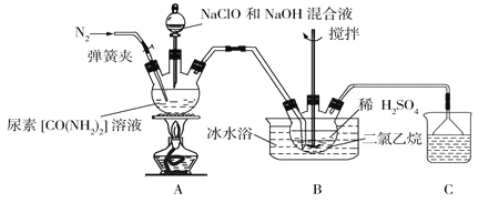
��1��ʢװ������Һ��װ������Ϊ__________________��
��2����ӦǰӦ��ͨ��һ��ʱ��ĵ�������Ŀ��Ϊ________________________________��
��3��װ��A�з�����Ӧ�Ʊ��µ����ӷ���ʽΪ__________________________________��
��4����Ӧ�����У������Һ©������Һ���ٹ��죬�ᵼ�������µIJ���ƫ�ͣ���ԭ����_________��
��5��װ��B�ж������������Ϊ_______________��ʹ�ñ�ˮԡ������Ϊ______________��
��6��װ��B��Ӧ��ȫ���辭�����ˡ�ϴ�ӡ�����Ȳ����õ������£�ϴ�ӹ��������ѡ����������ϴ�Ӽ�____________![]() ����ĸ
����ĸ![]() ��
��
A.��ˮ ![]() ��ˮ
��ˮ ![]() ��ˮ�Ҵ�
��ˮ�Ҵ� ![]() ����ʳ��ˮ
����ʳ��ˮ
��7�������»�ԭ![]() �����ķ�����ʵ���˷Ͼɵ����Ag�Ļ������ã��ֲ���Ի���������Ⱦ�������ϣ�
�����ķ�����ʵ���˷Ͼɵ����Ag�Ļ������ã��ֲ���Ի���������Ⱦ�������ϣ�![]() �����¿��Ƶ� ___________
�����¿��Ƶ� ___________![]() ��
��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����a��b��c��d��e�������壬�ֽ�������ʵ�飺
(1)a��b��� | ��������ɫ |
(2)c��d��� | �������� |
(3)c��e�ֱ�ͨ��������ˮ�� | ��ˮ�������ɫ����Һ�� |
(4)b��e�ֱ�ͨ���������� | ����������ɫ���� |
��a��b��c��d��e���ο����ǣ� ��
A. ![]() ��
��![]() ��HCl��
��HCl��![]() ��
��![]() B.
B. ![]() ��
��![]() ��
��![]() ��HCl��
��HCl��![]()
C. ![]() ��
��![]() ��
��![]() ��HCl��
��HCl��![]() D. HCl��
D. HCl��![]() ��
��![]() ��
��![]() ��
��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����йػ�ѧ����ı�����ȷ����(����)
A.�ڻ�̬�����ԭ���У�p�����������һ������s�����������
B.��̬Feԭ�ӵ���Χ�����Ų�ͼΪ![]()
C.����Ԫ�ص縺�Աȵ�Ԫ�ش���ԭ�ӵ�һ�����ܱȵ�ԭ�ӵ�һ�����ܴ�
D.����ԭ�Ӻ�������Ų����ص㣬Cu��Ԫ�����ڱ���λ��s��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵�����ʾ������ȷ����( )
A. �����������������������ֱ���ȫȼ��,���߷ų�������
B. ��C(ʯī)=C(���ʯ)��H=+1.9 kJ��mol-1��֪,���ʯ��ʯī�ȶ�
C. ��101kPaʱ,2g H2��ȫȼ������Һ̬ˮ,�ų�285.8kJ����,����ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ2H2(g)+O2(g)![]() 2H2O(l) ��H=+285.8 kJ��mol-1
2H2O(l) ��H=+285.8 kJ��mol-1
D. ��ϡ��Һ��:H++OH-![]() H2O ��H=-57.3 kJ��mol-1,������1mol CH3COOH�뺬1mol NaOH����Һ���,�ų�������С��57.3 kJ
H2O ��H=-57.3 kJ��mol-1,������1mol CH3COOH�뺬1mol NaOH����Һ���,�ų�������С��57.3 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±��Dz�ͬ�¶��µ����ӻ����ݣ�
�¶�(��) | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
�Իش��������⣺
(1)��25<t1<t2������____(����>������>������=��)1��10��14���������жϵ�������______��
(2)��t1ʱ����ô�ˮ�е�c(H��)=2.4��10��7mol/L����c(OH-)Ϊ______�����¶��£����ijH2SO4��Һ��c(SO42-)=5��10��6 mol��L��1������Һ��c(OH-)=__mol/L��
(3)��һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H>0�����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������__��
CH3CH3COO��+H+ ��H>0�����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������__��
a.��������0.10mol��L��1��ϡ���� b.����
c.��ˮϡ����0.010mol/L d.��������������
e.���������Ȼ��ƹ��� f.��������0.10mol��L��1��NaOH��Һ
(4)c(H+)��ͬ�ĵ������������ҺCH3COOH��HCl���ֱ���������п�۷�Ӧ��������˵����ȷ����__(��д���)
a.��Ӧ����Ҫ��ʱ��CH3COOH>HCl
b.��ʼ��Ӧʱ������HCl>CH3COOH
c.�μӷ�Ӧ��п�����ʵ����������
d.CH3COOH���ĵ�п�۵���������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com