
【题目】下表是不同温度下的离子积数据:
温度(℃) | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“>”、“>”或“=”)1×10-14,作出此判断的理由是______。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为______。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)=__mol/L。
(3)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L﹣1的NaOH溶液
(4)c(H+)相同的等体积的两份溶液CH3COOH和HCl,分别与足量的锌粉反应,则下列说法正确的是__(填写序号)
a.反应所需要的时间CH3COOH>HCl
b.开始反应时的速率HCl>CH3COOH
c.参加反应的锌粉物质的量二者相等
d.CH3COOH消耗的锌粉的质量更多
【答案】> 水的电离是吸热反应,升高温度,平衡向着正反应方向移动,c(H+)增大,c(OH-)增大,Kw= c(H+)·c(OH-),Kw增大 2.4×10-7mol/L 5.76×10-9mol/L bcf d
【解析】
(1)根据水的电离过程是吸热反应,温度升高,水的电离程度增大分析;
(2)在任何温度下水电离产生的H+、OH-离子浓度相等;根据硫酸电离产生的离子浓度关系计算溶液中c(H+),然后利用该温度下的水的离子积Kw计算该溶液中c(OH-);
(3)醋酸电离过程中吸热,用化学平衡移动原理分析判断;
(4)醋酸是一元弱酸,在溶液中存在电离平衡,物质的浓度c(CH3COOH)>c(HCl)=c(H+),根据溶液中含有的H+的物质的量或c(H+)变化分析。
(1)水是弱电解质,存在电离平衡,电离过程吸收热量,所以温度升高,水的电离程度增大,c(H+)增大,c(OH-)增大,Kw=c(H+)·c(OH-),水的离子积Kw增大,α>1×10-14;
(2)H2O电离产生H+、OH-,二者浓度相等,所以在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)=c(H+)=2.4×10-7mol/L;该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,根据硫酸的电离方程式H2SO4=2H++SO42-可知该溶液中c(H+)=2c(SO42-)=2×5×10-6 mol/L=10-5mol/L,在该温度下水的离子积常数Kw= c(H+)·c(OH-)=2.4×10-7mol/L×2.4×10-7mol/L,则该溶液中c(OH-)=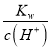 =
=![]() mol/L=5.76×10-9mol/L;
mol/L=5.76×10-9mol/L;
(3)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ ,醋酸电离吸收热量,△H>0。
CH3CH3COO﹣+H+ ,醋酸电离吸收热量,△H>0。
a.加入少量0.10mol·L﹣1的稀盐酸,使溶液中c(H+)增大,平衡逆向移动,CH3COOH电离程度减小,a不符合题意;
b.醋酸电离过程中吸收热量,加热升高温度,平衡向电离的方向移动,醋酸电离程度增大,b符合题意;
c.加水稀释至0.010mol/L,电离平衡正向移动,醋酸电离程度增大,c符合题意; d.加入少量冰醋酸,醋酸的浓度增大,电离平衡正向移动,但醋酸的电离程度降低,d不符合题意;
e.加入少量氯化钠固体,电离产生的离子对醋酸的电离平衡无影响,e不符合题意; f.加入少量0.10mol·L﹣1的NaOH溶液,OH-与醋酸电离产生的H+结合生成水,使溶液中c(H+)降低,平衡正向移动,f符合题意;
故合理选项是bcf;
(4)a.醋酸是一元弱酸,在溶液中存在电离平衡,HCl和醋酸的中c(H+)相同,则c(CH3COOH)>c(HCl),反应过程中c(H+):醋酸>HCl,所以反应所需要的时间CH3COOH<HCl,a错误;
b.反应开始反应时溶液中c(H+)相等,所以反应开始时的速率:HCl=CH3COOH,b错误;
c.由于两种溶液中溶质的物质的量n(CH3COOH)>n(HCl),所以参加反应的锌粉物质的量醋酸>盐酸,c错误;
d.溶液中CH3COOH的物质的量比盐酸中的HCl的物质的量多,所以消耗的锌粉的质量更多,d正确;
故合理选项是d。


科目:高中化学 来源: 题型:
【题目】中国工程院院士李兰娟团队,于 2020 年 2 月 4 日公布治疗新冠病毒感染的肺炎最新研究成果。他们初步测试发现,在体外细胞实验中,阿比朵尔在 10~30 微摩尔浓度 下,与药物未处理的对照组比较,能有效抑制冠状病毒达 60 倍,并有显著抑制病毒对细 胞的病变效应。 因此“阿比朵尔”成为抗击新型冠状病毒潜在用药,其合成路线如下:
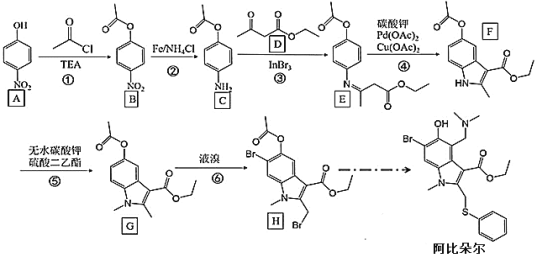
回答下列问题:
(1)有机物 A 的名称是____________。
(2)反应②、⑥反应类型分别是_________、______________。
(3)F 中含氧官能团的名称是_______________;G 的分子式为_______________。
(4)请写出反应③的化学反应方程式______________________________________。
(5)M 是 B 的一种同分异构体,满足下列条件的同分异构体有________种:①苯环上有3 个取代基;②能发生银镜反应;③能发生水解反应,且 1 mol M 水解消耗 4mol NaOH。其中核磁共振氢谱为有 4 组峰,峰面积之比为 2:2:2:1 的结构简式为_____。
(6)设计由甲苯和 2-丙醇为原料制备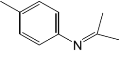 的合成路线_____。
的合成路线_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 是原子序数依次增大的短周期元素,且
是原子序数依次增大的短周期元素,且![]() 原子序数之和是
原子序数之和是![]() 原子序数之和的
原子序数之和的![]() 。甲、乙、丙、丁是由这些元素组成的二元化合物,
。甲、乙、丙、丁是由这些元素组成的二元化合物,![]() 是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物
是某种元素对应的单质,乙和丁的组成元素相同,且乙是一种“绿色氧化剂”,化合物![]() 是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是
是具有漂白性的气体(常温下)。上述物质间的转化关系如图所示(部分反应物和生成物省略)。下列说法正确的是

A. 由四种元素形成的两种盐,水溶液中反应能生成![]()
B. ![]() 与
与![]() 形成的化合物中阴、阳离子个数比可为1:1
形成的化合物中阴、阳离子个数比可为1:1
C. 化合物![]() 、乙烯使溴水褪色的原理相同
、乙烯使溴水褪色的原理相同
D. ![]() 与
与![]() 形成的化合物中,成键原子均满足8电子结构
形成的化合物中,成键原子均满足8电子结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在指定溶液中一定能大量共存的是
A. 无色透明溶液中: H+、Na+、MnO![]() 、SO
、SO![]()
B. 碱性溶液中:Na+、K+、SiO![]() 、NO
、NO![]()
C. 能溶解Al2O3的溶液中:Mg2+、Cu2+、HCO![]() 、Cl-
、Cl-
D. 含有Fe2+的溶液中:H+、Ca2+、NO![]() 、AlO
、AlO![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4-溴甲基-1-环己烯的一种合成路线如下,下列说法正确的是
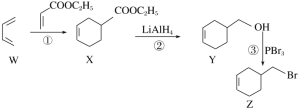
A.X、Y、Z都属于芳香族化合物
B.①②③的反应类型依次为加成反应、还原反应和取代反应
C.由化合物Z一步制备化合物Y的转化条件是:NaOH醇溶液,加热
D.化合物Y先经酸性高锰酸钾溶液氧化,再与乙醇在浓硫酸催化下酯化可制得化合物X
查看答案和解析>>
科目:高中化学 来源: 题型:
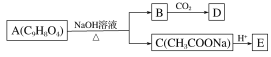
【题目】为药用有机物,存在如图所示的转化关系。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基处于邻位,D能跟NaOH溶液反应。
请回答:
(1)A转化为B、C时,涉及的反应类型有____________________________________、_______________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。Q、R的结构简式为Q________________;R________________。
(3)D的结构简式为____________。
(4)写出A在加热条件下与NaOH溶液反应的化学方程式:______________________。
(5)已知:![]()
![]()
 请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。
请选用适当物质设计一种合成方法。用邻甲基苯酚经两步反应合成有机物A,在方框中填写有机物的结构简式。![]()
![]()
![]()
![]() 有机物A。
有机物A。
___________; ____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是与人类生活密切相关的一种重要元素。根据要求回答:
(1)写出N2的电子式_________;将空气中的氮气转化为含氮化合物的过程称为固氮,当今大规模人工固氮的主要方法是(用化学方程式表示)______________________________。
(2)某无色混合气体中可能含有NH3、O2、H2、NO、HCl等气体,将它通过浓H2SO4 后发现气体体积减少,将剩余气体与空气接触后呈红棕色,此混合气中一定不含有_________。
(3)实验室有多种制取氨气的方法,其中加热消石灰与氯化铵的混合固体就是方法之一。
①写出此反应的化学方程式:_____________________________________________。
②氨气可使湿润的红色石蕊试纸变蓝的原因(用相应的方程式说明)_______________。
③用乙装置(见图)吸收一段时间氨气后,再通入空气,同时将加热的铂丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是___(选填序号)。

a H2 b NO2 c HNO3 d NH4NO3
写出乙装置中氨催化氧化的化学方程式:__________________________。
(4)已知3Cl2+2NH3==N2 + 6HCl,若NH3过量则还有反应:NH3+ HCl== NH4Cl 。常温常压下,若在一密闭容器中将15mLCl2和40mL NH3充分混合反应后,剩余气体的体积为____mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
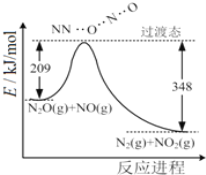
【题目】(1)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=___kJ·mol-1。
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=akJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH=bkJ·mol-1
③Si(s)+O2(g)=SiO2(s) ΔH=ckJ·mol-1
工业上生产粗硅的热化学方程式为__。
(3)在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125kJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明苯加氢生成环己烷是__反应。(填放热或吸热)
(4)X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素电子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是__。(填化合物的化学式)
(5)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,1mol胆矾脱水需__kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
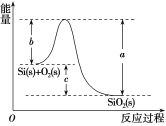
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com