
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
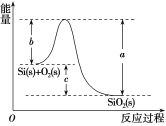
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
科目:高中化学 来源: 题型:
【题目】下表是不同温度下的离子积数据:
温度(℃) | 25 | t1 | t2 |
水的离子积常数 | 1×10-14 | α | 1×10-12 |
试回答以下问题:
(1)若25<t1<t2,则α____(填“>”、“>”或“=”)1×10-14,作出此判断的理由是______。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为______。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)=__mol/L。
(3)在一条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
CH3CH3COO﹣+H+ △H>0,下列方法中,可以使0.10mol·L﹣1CH3COOH溶液中CH3COOH电离程度增大的是__。
a.加入少量0.10mol·L﹣1的稀盐酸 b.加热
c.加水稀释至0.010mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol·L﹣1的NaOH溶液
(4)c(H+)相同的等体积的两份溶液CH3COOH和HCl,分别与足量的锌粉反应,则下列说法正确的是__(填写序号)
a.反应所需要的时间CH3COOH>HCl
b.开始反应时的速率HCl>CH3COOH
c.参加反应的锌粉物质的量二者相等
d.CH3COOH消耗的锌粉的质量更多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蚀刻铜制线路板的蚀刻液种类很多:酸性蚀刻液,如![]() 蚀刻溶液、H2O2-盐酸及CuCl2-盐酸
蚀刻溶液、H2O2-盐酸及CuCl2-盐酸![]() 碱性蚀刻液,如
碱性蚀刻液,如![]() 溶液等。回答下列问题:
溶液等。回答下列问题:
(1)写出下列蚀刻液蚀刻铜的离子方程式。
①FeCl3溶液:_______。
②H2O2-盐酸:_______。
③![]() 溶液:_______
溶液:_______![]() 生成
生成![]() 。
。
(2)利用废![]() 蚀刻液
蚀刻液![]() 含
含![]() 、
、![]() 及
及![]() 制备碱性蚀刻液
制备碱性蚀刻液![]() 溶液和
溶液和![]() 的主要步骤包括:用
的主要步骤包括:用![]() 氧化废蚀刻液,通入氨气
氧化废蚀刻液,通入氨气![]() ,固液分离,用盐酸溶解沉淀和
,固液分离,用盐酸溶解沉淀和![]() 的制备。下列实验装置不能达到实验目的的是_______
的制备。下列实验装置不能达到实验目的的是_______![]() 填字母
填字母![]() 。
。
A. 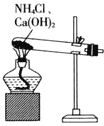 制备
制备![]()
B. 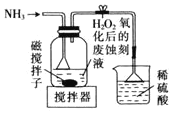 制备
制备![]() 并沉铁
并沉铁
C. 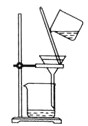 分离
分离![]() 溶液和
溶液和![]() 沉淀
沉淀
D.  将
将![]() 溶液蒸干制备
溶液蒸干制备![]()
(3)常用水合肼![]() 还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
还原法回收CuCl2-盐酸蚀刻液得到单质铜,先用氢氧化钠溶液中和其中酸并将溶液调至强碱性,然后加入水合肼得纳米铜,该氧化还原反应中氧化剂与还原剂的物质的量之比为_______。
(4)文献报道一种回收蚀刻废液中铜并制取胆矾![]() 的主要工艺流程如下:
的主要工艺流程如下:
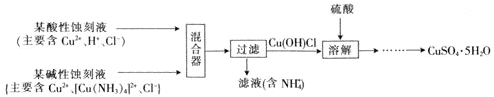
已知:![]() 易与酸反应。
易与酸反应。
![]() 在混合器中,
在混合器中,![]() 的离子方程式为_______。
的离子方程式为_______。
![]() 溶于硫酸的离子方程式为_______。
溶于硫酸的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳元素构成的各种单质和化合物始终都是科学家研究的重要对象。
Ⅰ.甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用转化中得到的合成气制备甲醇。反应为CO(g)+2H2(g)![]() CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
CH3OH(g),某温度下,在容积为2L的密闭容器中进行该反应,其相关数据见图:
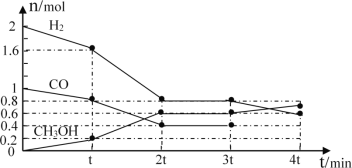
①根据图计算,从反应开始到tmin时,用H2浓度变化表示的平均反应速率υ(H2)=__。
②tmin至2tmin时速率变化的原因可能是__(要求答出所有可能原因)。
Ⅱ.一定温度下,向一容积为5L的恒容密闭容器中充入0.4molSO2和0.2molO2,发生反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的
2SO3(g) ΔH=-196kJ·mol-1。当反应达到平衡时,容器内压强变为起始时的![]() 。请回答下列问题:
。请回答下列问题:
①SO2的转化率为__;
②达到平衡时反应放出的热量为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池是目前电池研究的热点之一。某课外小组自制的氢氧燃料电池如图所示,a、b均为惰性电极下列叙述不正确的是( )

A.a极是负极,该电极上发生氧化反应
B.b极发生的电极反应是O2+4OH--4e-=2H2O
C.电池总反应方程式为2H2+O2=2H2O
D.氢氧燃料电池是一种具有应用前景的绿色电源
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳排放是影响气候变化的重要因素之一。科学家研发出一种新系统,“溶解”水中的二氧化碳,以触发电化学反应,生成氢气,其工作原理如图所示。下列有关说法不正确的是( )
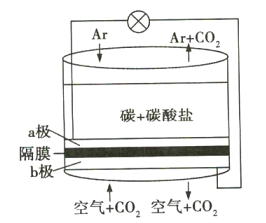
A.a极通Ar气的目的是增强导电能力
B.a极的电极反应式为![]()
C.电流由b极沿导线经负载再流向a极
D.![]() 由b极区透过隔膜流向a极区
由b极区透过隔膜流向a极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】淮南是我国重要的煤炭生产基地,通过煤的气化和液化,能使煤炭得以更广泛的应用。
I.工业上先将煤转化为CO,再利用CO和水蒸气反应制H2时,存在以下平衡:
CO(g)+H2O(g)![]() CO2(g)+H2(g)
CO2(g)+H2(g)
(1)向2L恒容密闭容器中充入CO和H2O(g),800℃时测得部分数据如下表。
t/min | 0 | 1 | 2 | 3 | 4 |
n(H2O)/mol | 1.20 | 1.04 | 0.90 | 0.70 | 0.70 |
n(CO)/mol | 0.80 | 0.64 | 0.50 | 0.30 | 0.30 |
则从反应开始到2min时,用H2表示的反应速率为_________________;该温度下反应的平衡常数K=___________________(小数点后保留1位有效数字)。
(2)相同条件下,向2L恒容密闭容器中充入1molCO、3mol H2O(g)、2molCO2(g)、2mo1 H2(g),此时v正________v逆(填“>” “<” 或 “=”)。
Ⅱ.一定条件下用CO和H2合成CH3OH:CO(g)+2H2(g)CH3OH(g)△H=﹣105kJmol﹣1.向体积为2L的密闭容器中充入2mol CO和4mol H2,测得不同温度下容器内的压强(P:kPa)随时间(min)的变化关系如右图中Ⅰ、Ⅱ、Ⅲ曲线所示:
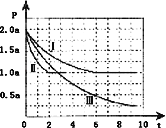
(1)Ⅱ和Ⅰ相比,改变的反应条件是______.
(2)反应Ⅰ在6min时达到平衡,在此条件下从反应开始到达到平衡时v(CH3OH)=______.
(3)反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ)=______.
(4)比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1_____T3(填“>”“<”“=”),判断的理由是_________________________________________________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方而获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示:
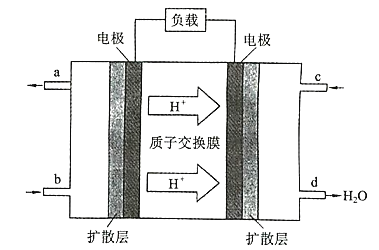
(1)该电池工作时,b处通入的物质为 ______________ ,c 通入 的物质为______。
(2)该电池负极的电极反应式为 _________________ 。
(3)工作一段时间后,当12.8g甲醇完全反应生成 CO2时时,有_________×6.02×1023个电子发生转移。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、X均为中学化学常见物质,一定条件下它们有如图所示转化关系(部分产物已略去)。下列说法正确的是( )

A. 若X为KOH溶液,则A可能为Al
B. 若X为Fe,则C可能为Fe(NO3)2溶液
C. 若A、B、C均为焰色反应呈黄色的化合物,则X一定为CO2
D. 若X为O2,则A可为有机物乙醇,也可为非金属单质硫
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com