
【题目】中国科学院长春应用化学研究所在甲醇(CH3OH)燃料电池方而获得新突破,研制出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示:
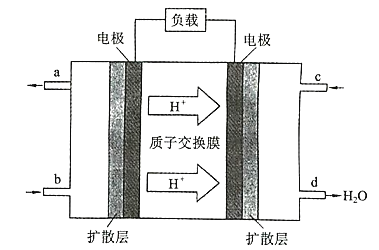
(1)该电池工作时,b处通入的物质为 ______________ ,c 通入 的物质为______。
(2)该电池负极的电极反应式为 _________________ 。
(3)工作一段时间后,当12.8g甲醇完全反应生成 CO2时时,有_________×6.02×1023个电子发生转移。
【答案】CH3OH O2 CH3OH-6e-+H2O=CO2↑+6H+ 2.4
【解析】
(1)根据图中氢离子的移动方向可判断出右侧电极是正极,左侧电极是负极,负极通入的是甲醇,所以b处通入的物质是CH3OH,正极通入的是空气或氧气,所以c处通入的物质是空气或氧气。
(2)负极发生氧化反应,根据图中所给信息可知,正极上氧气得电子和氢离子反应生成水,电极反应式为:O2+4H++4e-=2H2O,负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e+H2O=CO2↑+6H+;
(3)负极上甲醇失电子和水反应生成二氧化碳和氢离子,电极反应式为CH3OH-6e+H2O=CO2↑+6H+,工作一段时间后,当12.8g甲醇即0.4mol甲醇完全反应生成CO2时,有2.4mol即2.4NA个电子转移。


 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案科目:高中化学 来源: 题型:
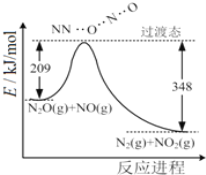
【题目】(1)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1molN2,其△H=___kJ·mol-1。
(2)已知:①C(s)+O2(g)=CO2(g) ΔH=akJ·mol-1
②CO2(g)+C(s)=2CO(g) ΔH=bkJ·mol-1
③Si(s)+O2(g)=SiO2(s) ΔH=ckJ·mol-1
工业上生产粗硅的热化学方程式为__。
(3)在烃分子中去掉2个氢原子形成一个双键是吸热反应,大约需117kJ/mol~125kJ/mol的热量,但1,3—环己二烯失去2个氢原子变成苯是放热反应,△H=-23.4kJ/mol,以上事实表明苯加氢生成环己烷是__反应。(填放热或吸热)
(4)X、Y两元素的原子,当它们分别获得两个电子形成稀有气体元素电子层结构时,X放出的热量大于Y放出的热量;Z、W两元素的原子,当它们分别失去一个电子形成稀有气体元素原子的电子层结构时,吸收能量W大于Z。则X、Y和Z、W分别形成的化合物中,离子化合物可能性最大的是__。(填化合物的化学式)
(5)称取等质量为(ag)胆矾两份。把一份溶于bg水中,测知其溶解时吸收Q1kJ热量;把另一份脱水后溶于bg水中,测得其溶解时放热Q2kJ。从以上数据可知,1mol胆矾脱水需__kJ热量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①1mol晶体硅中含有2molSi—Si键。
②Si(s)+O2(g)===SiO2(g) ΔH,其反应过程与能量变化如图所示。
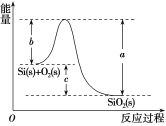
③
化学键 | Si—O | O=O | Si—Si |
断开1 mol共价键所需能量/kJ | 460 | 500 | 176 |
下列说法中正确的是( )
A.晶体硅光伏发电是将化学能转化为电能B.二氧化硅稳定性小于硅的稳定性
C.ΔH=-988kJ·mol-1D.ΔH=(a-c)kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二茂铁[(C5H5)2Fe]分子是一种金属有机配合物,是燃料油的添加剂,用以提高燃烧的效率和去烟,可作为导弹和卫星的涂料等。它的结构如图所示,下列说法不正确的是
A.二茂铁属于分子晶体
B.环戊二烯中碳原子的杂化方式有sp3和sp2
C.1mol 环戊二烯( ![]() )中含有σ键的数目为5NA
)中含有σ键的数目为5NA
D.二茂铁分子中的化学键有极性共价键、非极性共价键和配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢是重要而洁净的能源。要利用氢气作为能源,必须解决好安全有效地储存氢气的问题。镧(La)镍(Ni)合金是一种储氢材料,这种合金的晶体结构已经测定,其基本结构单元如图所示,有关其说法正确的是
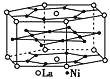
A.不属于金属晶体
B.该合金的化学式为La7Ni12
C.其熔点比组分金属低,硬度比组分金属大
D.设该结构单元的体积为Vcm3,NA为阿伏加德罗常数,合金的摩尔质量为M g/mol。则该合金的密度为ρ= 3![]() g/ cm3
g/ cm3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、铁是生产、生活及生命中的重要元素。
(1)血红蛋白(Hb)中的铁元素呈正二价,能与O2分子结合成氧合血红蛋白(HbO)从而有输送氧的能力。NaNO2因具有氧化性能使血红蛋白丧失与O2结合能力。药品美蓝是其有效的解毒剂,解毒时美蓝发生_____反应(填“氧化”或“还原”)。
(2)普通铁粉与水蒸气在高温下反应生成铁的某种氧化物和氢气,该氧化物和氢气在高温下发生逆反应得到“引火铁”。 “引火铁”是一种极细的铁粉,它在空气中可以自燃,其原因是_____________。
Ⅱ、在1 L 2 mol·L-1稀硝酸溶液中逐渐加入铁粉,反应中氧化产物的物质的量与加入铁粉的物质的量的关系如图所示:
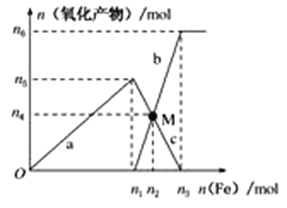
回答下列问题:
(1)写出加入n1mol铁所发生反应的离子方程式_______________________________。
(2)整个过程中转移电子的数目是________。
(3)若M点时再加入V L 2 mol·L-1的稀硝酸,恰好反应完全,则V为___________。
(4)研究表明硝酸的浓度越小,反应后氮的化合价越低。在极稀的硝酸溶液中加入少量铁粉,生成NH4+的离子方程式为___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将Al条插入6 mol·L-1盐酸中,反应过程中产生H2速率变化情况如图1所示。下列说法错误的是
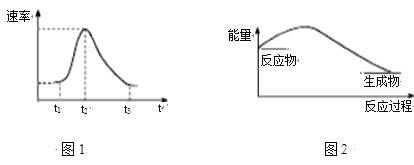
A. 图1中开始阶段产生气体速率较慢可能是因为Al条表面有氧化膜
B. 图1中影响t1~t2段速率变化的主要原因是反应放热导致溶液温度升高
C. 图1中影响t2~t3速率变化的主要因素是c(Cl-)
D. 图2可以表示该反应过程的能量变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国首创的海洋电池以铝板为负极,铂网为正极,海水为电解质溶液,电池总反应为4Al+3O2+6H2O=4Al(OH)3。下列说法不正确的是( )
A.正极的电极反应为O2+2H2O+4e-=4OH-
B.电池工作时,电流由铝电极沿导线流向铂电极
C.以网状的铂为正极,可增大其与氧气的接触面积
D.该电池通常只需要更换铝板就可继续使用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计实验用图甲装置探究工业制乙烯的原理和乙烯的主要化学性质,用图乙装置探究苯与液溴的反应。请回答下列问题:
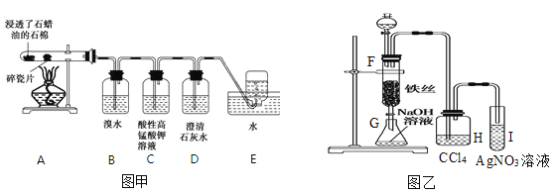
(1)工业制乙烯的实验原理是烷烃(液态)在催化剂和加热条件下发生反应生成不饱和烃。
例如:石油分馏产物之一的十六烷烃发生反应: C16H34 ![]() C8H18+甲,甲
C8H18+甲,甲![]() 4乙,则甲的分子式为________,乙的结构简式为_____________。
4乙,则甲的分子式为________,乙的结构简式为_____________。
(2)B装置中的实验现象可能是_____,写出反应的化学方程式:_____,其反应类型是____。
(3)实验反应完毕后I试管中的现象是__________。
(4)检验甲烷和乙烯的方法是________(选填字母下同),除去甲烷中乙烯的方法是__________。
A.气体通入水中 B.气体通过盛溴水的洗气瓶 C.气体通过盛酸性高锰酸钾溶液的洗气瓶 D.气体通过氢氧化钠溶液
(5)根据乙烯和苯的性质写出以下反应的化学方程式:
由乙烯制氯乙烷 :__________________, 由苯制硝基苯 :______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com