
【题目】下列实验装置能达到实验目的是(夹持仪器未画出)( )
A.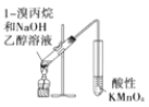 用于检验溴丙烷消去产物
用于检验溴丙烷消去产物
B.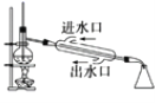 用于石油的分馏
用于石油的分馏
C.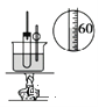 用于实验室制硝基苯
用于实验室制硝基苯
D.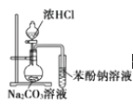 可证明酸性:盐酸>碳酸>苯酚
可证明酸性:盐酸>碳酸>苯酚
【答案】C
【解析】
A.1-溴丙烷在氢氧化钠乙醇溶液中共热发生消去反应生成丙烯,丙烯能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,而乙醇具有挥发性,挥发出的乙醇也能被酸性高锰酸钾溶液氧化,使酸性高锰酸钾溶液褪色,干扰烯烃的检验,则该实验不能说明烯烃的生成,故A错误;
B.由图可知,装置中温度计水银球的位置错误,分馏时应与蒸馏瓶支管下沿平齐测定馏出物的温度,冷凝管中冷凝水的流向错误,冷凝水应从下方进上方出,增强冷凝效果,故B错误;
C.实验室在浓硫酸作用下,苯和浓硝酸在50-60℃条件下发生硝化反应制硝基苯,实验时需要用水浴加热,故C正确;
D.盐酸的酸性强于碳酸,浓盐酸易挥发,挥发出的氯化氢可与苯酚钠反应制取苯酚,干扰碳酸和苯酚酸性的干扰,则该实验不能证明酸性碳酸>苯酚,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】运用有关概念判断下列叙述正确的是( )
A.1mol H2燃烧放出的热量为H2的燃烧热
B.Na2SO3和H2O2的反应为氧化还原反应
C.![]() 和
和![]() 互为同系物
互为同系物
D.BaSO4的水溶液不导电,故BaSO4是弱电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时醋酸的电离常数为1.6×10-5,该温度下向20 mL 0.01 mol·L-1醋酸溶液中不断滴入0.01 mol·L1 NaOH(aq),溶液pH变化如图所示。此过程溶液中离子浓度的关系错误的是
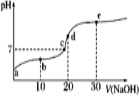
A. a点溶液的c(H+)=4×10-4mol·L-1
B. 水电离程度:e>d>c>b>a
C. b点:2c(Na+)=c(CH3COO-)+c(CH3COOH)
D. d点:c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
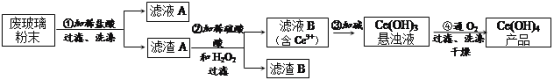
(1)洗涤滤渣A的目的是为了去除_______(填离子符号),检验该离子是否洗涤的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________,滤渣B的主要成分是_________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有_________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000molL-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中 F 可以作内燃机的抗冻剂,J 分子中无饱和碳原子。已知:R1—CH==CH—R2→R1—CHO+R2—CHO
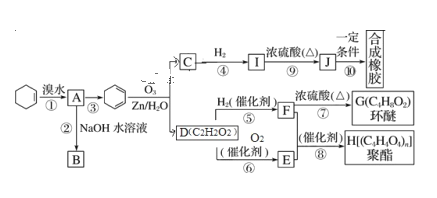
(1)A的结构简式为_____③的反应试剂及条件是______
(2)有机物B和 I的关系为_____(填字母)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(3)H的名称_________
(4)写出下列反应的化学方程式并注明反应类型:
反应⑨_________;________
(5)写出两种C的属于酯类的链状同分异构体的结构简式:_________;________
(6)参照题给信息,试写出以 2-丁烯为原料制取乙酸乙酯的合成路线流程图(无机原料任选)
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )

A.分子式为C9H8O4
B.1mol 乙酰水杨酸最多可以与2molNaOH反应
C.1mol乙酰水杨酸最多可以与3molH2反应
D.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

(1)废铁渣进行“粉碎”的目的是_____。
(2)①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____。
②酸浸时,通入O2的目的是_____。
(3)滤渣的主要成分为____(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-![]() 被还原为Cr3+),该滴定反应的离子方程式为_____。
被还原为Cr3+),该滴定反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_______(写出化学式)。
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为______(写出化学式)。 实验室过滤需用到的玻璃仪器有烧杯、__________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______。
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
实验序号 | I | II | III |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为_____。
②所用NaOH溶液的浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合元素周期表,回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图 1 中用实线补全元素周期表 的边界____________
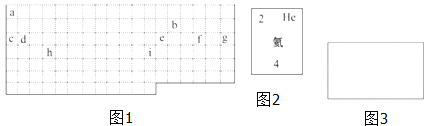
(2)表中所列元素,属于短周期元素的有____________;属于主族元素的有____________;g 元素位于第____________ 周期____________ 族;i 元素位于第____________ 周期____________族.
(3)元素 f 是第_______周期、第_______ 族元素,请在如图 3 所示的方框中按 氦元素(图 2)的式样写出该元素的原子序数、元素符号、元素名称、相对原子 质量_______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com