
����Ŀ����ͼ�Ǵ���ʿ����Ҫ�ɷ�ΪAl2O3������������SiO2��Fe2O3�����ʣ�����ȡAl2O3������AlN�Ĺ������̣�

��1�����ܽ⡱ʱ����Һ�еĹ�������ƫ�����Ʒ�����Ӧ��2Na2SiO3+2NaAlO2+2H2O��Na2Al2Si2O8��+4NaOH���������Ҫ�ɷ�Ϊ_______��д����ѧʽ����
��2�����ữ��ʱͨ�����CO2��NaAlO2��Ӧ����Al(OH)3����Һ����Ҫ�ɷ�Ϊ______��д����ѧʽ���� ʵ���ҹ������õ��IJ����������ձ���__________����������
��3������ԭ��ʱ��̿���ڸ����±�����ΪCO����Ӧ�Ļ�ѧ����ʽΪ_______��
��4����ȡ���ݲ�ͬ�����ĵ�������Ʒ����������ֻ����̿�ڣ��ֱ�ӵ�20.00 mL��ͬŨ�ȵ�NaOH��Һ�У���ַ�Ӧ���ʵ���������±���ʾ������֪��AlN+NaOH+H2O��NaAlO2+NH3����
ʵ����� | I | II | III |
���뵪������Ʒ������/g | 4.1 | 8.2 | 12.3 |
���ɰ��������/L����״���� | 1.456 | 2.912 | 4.256 |
�ٸ���Ʒ��AlN����������Ϊ_____��
������NaOH��Һ��Ũ��Ϊ___mol/L��
���𰸡�Fe2O3��Na2Al2Si2O8 NaHCO3 ©�� ![]() 65% 9.5
65% 9.5
��������
��ʿ��(��Ҫ�ɷ�ΪAl2O3������������SiO2��Fe2O3������)����ʿ���м�������������Һ��SiO2��Al2O3��������������Һ����Һ�еĹ�������ƫ�����Ʒ�����Ӧ:2Na2SiO3+2NaAlO2+2H2O�TNa2Al2Si2O8��+4NaOH������������������������Һ�����Թ��˵ó���ΪFe2O3��Na2Al2Si2O8����Һ��ҪΪƫ��������Һ��ƫ��������Һ��ͨ������Ķ�����̼������������������NaHCO3��Һ�������������յ�����������������̼�������ڸ��������ɵ��������ݴ˴��⡣
��1�����ܽ���ʱ����Һ�еĹ�������ƫ�����Ʒ�����Ӧ��2Na2SiO3+2NaAlO2+2H2O��Na2Al2Si2O8��+4NaOH������������������������Һ�����Թ��˵ó���ΪFe2O3��Na2Al2Si2O8���������Ҫ�ɷ�ΪFe2O3��Na2Al2Si2O8��
��2�����ữ��ʱͨ�����CO2��NaAlO2��Ӧ����Al(OH)3������NaHCO3��������Һ����Ҫ�ɷ�ΪNaHCO3���������õ��IJ����������ձ���©������������
��3������ԭ��ʱ��̿�ڡ���������N,�ڸ��������ɵ�������CO����Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
��4�����������Ʒ�������������ɰ������������˵��ʵ��I����Ʒ��ȫ��Ӧ������������ʣ�࣬��״����1.456L���������ʵ�����![]() ����ʵ��I����Ʒ��AlN������Ϊxg��
����ʵ��I����Ʒ��AlN������Ϊxg��
AlN+NaOH+H2O��NaAlO2+NH3��
41g 1mol
xg 0.065mol
![]() ��x=2.665g��
��x=2.665g��
����Ʒ��AlN����������Ϊ![]() ��
��
ʵ��III��Ʒ��������ʵ��I����Ʒ������3���������ɰ��������С��ʵ��I��3����˵��ʵ��III��Ʒ��ʣ�࣬����������Һ��ȫ��Ӧ����״����4.256 L���������ʵ�����![]() ��
��
AlN+NaOH+H2O��NaAlO2+NH3��
1mol 1mol
xmol 0.19mol
![]() ��x=0.19mol��NaOH��Һ��Ũ��Ϊ
��x=0.19mol��NaOH��Һ��Ũ��Ϊ![]() 9.5mol/L��
9.5mol/L��


 ���㼤�������100�ִ��Ծ�ϵ�д�
���㼤�������100�ִ��Ծ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��X��Y��Z��WΪԭ��������������Ķ���������Ԫ�ء�X�ֱ���Y��Z��W����γ���������ͬ�ļס��ҡ������ַ��ӡ���Ϊ��ɫ���壬�����������ɫ������ˮ��Һ�ɿ�ʴ������
������������ͼת����ϵ��

����˵���������
A. ����Ԫ���γɵĵ�����W����������ǿ
B. �ס��ҡ����зе���ߵ��DZ�
C. �׳����������
D. �ס��ҷ��Ӿ�ֻ�����Թ��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʵ��װ���ܴﵽʵ��Ŀ����(�г�����δ����)( )
A.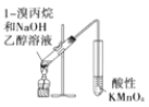 ���ڼ����������ȥ����
���ڼ����������ȥ����
B.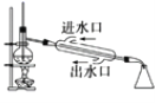 ����ʯ�͵ķ���
����ʯ�͵ķ���
C.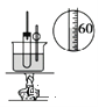 ����ʵ������������
����ʵ������������
D.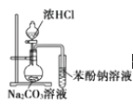 ��֤�����ԣ����̼�����
��֤�����ԣ����̼�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��5���л���ѧ����]
�л���F���л��ϳɹ�ҵ��һ����Ҫ���м��塣�Լױ��ͱ�ϩΪ��ʼԭ�Ϻϳ�F�Ĺ����������£�
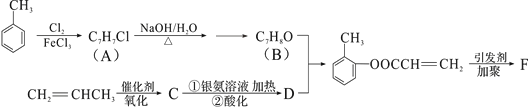
�ش��������⣺
��1��������B�к���������������_________F�Ľṹ��ʽ__________________
��2��д��C��������Һ���ȵĻ�ѧ��Ӧ����ʽ��_______________________
��3��������D���ܷ����ķ�Ӧ��__________________������ţ���
�ټӳɷ�Ӧ��ȡ����Ӧ����ȥ��Ӧ��������Ӧ��ˮ�ⷴӦ
��4��B�ĺ������ṹ��ͬ���칹�廹��__________�֣�����һ�ֵĺ˴Ź��������г���4�����Ҳ���FeCl3��Һ������ɫ��Ӧ����____________����ṹ��ʽ����
��5��B��D������Ӧ������________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����6 mol CO2��8 mol H2����һ�ݻ�Ϊ2 L���ܱ�������(�¶ȱ��ֲ���)������ӦCO2(g)��3H2(g)![]() CH3OH(g)��H2O(g)����H��0�����H2�����ʵ�����ʱ��仯��ͼ��ʾ(ͼ����ĸ������ֱ�ʾ��Ӧ������)���÷�Ӧ��8��10 min��CO2��ƽ����Ӧ������
CH3OH(g)��H2O(g)����H��0�����H2�����ʵ�����ʱ��仯��ͼ��ʾ(ͼ����ĸ������ֱ�ʾ��Ӧ������)���÷�Ӧ��8��10 min��CO2��ƽ����Ӧ������

A. 0.5 mol��L��1��min��1B. 0.1 mol��L��1��min��1
C. 0 mol��L��1��min��1D. 0.125 mol��L��1��min��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ�������ܱ������д������·�Ӧ��2A(g)+B(g)![]() 3C(g)+D(s)��H<0����������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�������ȷ����
3C(g)+D(s)��H<0����������������ʱ���ı�ijһ������������Ӧ��Ӱ�죬���з�������ȷ����
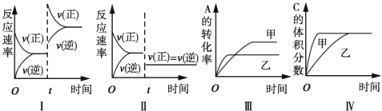
A. ͼI��ʾ���ӷ�Ӧ��Ũ�ȶԸ�ƽ���Ӱ��
B. ͼII��ʾ��Сѹǿ�Ը�ƽ���Ӱ��
C. ͼ���ʾ�¶ȶԸ�ƽ���Ӱ�죬�¶ȣ���>��
D. ͼIV��ʾ�����Ը�ƽ���Ӱ�죬��Ч�ʣ���>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ToC�£������Ϊ2 L�ĺ����ܱ�������ͨ��NO2��O2��������Ӧ��4NO2(g)+O2(g)![]() 2N2O5(g)��H��0������ʵ���������±�������˵������ȷ����
2N2O5(g)��H��0������ʵ���������±�������˵������ȷ����
ʱ��/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s��NO2��ƽ����Ӧ����Ϊ0.3 mol/(Ls��
B. ��10 sʱ�����������г���2 mol N2O5(g)������ƽ���£�NO2���������������
C. ��5 s ʱ�����ھ��Ⱥ����´�ƽ�⣬��ƽ���µ�ƽ�ⳣ����ԭƽ���С
D. ToC���÷�Ӧ��ƽ�ⳣ��Ϊ0.125����Ӧ���ƽ��ת���ʾ�Ϊ50%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ϊ2L�ĺ����ܱ������м���![]() ��һ������CO������Ӧ��
��һ������CO������Ӧ��![]() ��CO��
��CO��![]()
![]() �����ʵ�����ʱ��ı仯���±���ʾ��������˵��������ǣ� ��
�����ʵ�����ʱ��ı仯���±���ʾ��������˵��������ǣ� ��
| 0 | 3 | 10 | 12 |
| 2 | 1 |
|
|
| 0 | 1 |
|
|
A.��![]() �ڣ���
�ڣ���![]() ��ʾ��ƽ����Ӧ����Ϊ
��ʾ��ƽ����Ӧ����Ϊ![]()
B.�ڸ������£�������Ӧ��ƽ�ⳣ��Ϊ3
C.��Ӧ��ƽ��ʱ��![]()
![]() ���������Ϊ
���������Ϊ![]()
D.Ҫ����Ӧ����������![]()
![]() �ڻ�����е�����������ɲ���ѹ�������������ϵѹǿ�Ĵ�ʩ
�ڻ�����е�����������ɲ���ѹ�������������ϵѹǿ�Ĵ�ʩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�����в�����![]() ��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������
��NOֱ���ŷŽ��Դ������������Ⱦ�����õ绯ѧԭ������![]() ��NO��ͬʱ���
��NO��ͬʱ���![]() ��
��![]() ��Ʒ�Ĺ�������ͼ����
��Ʒ�Ĺ�������ͼ����![]() Ϊ��Ԫ��
Ϊ��Ԫ��![]() ��
��
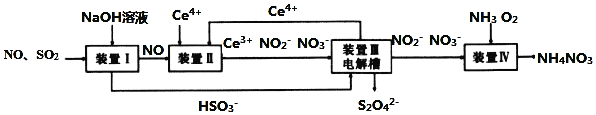
��ش��������⣮
![]() ��װ�â��з�Ӧ���ɵĺ�������������ʵ�����Ϊ1��1����÷�Ӧ�����ӷ���ʽ____��
��װ�â��з�Ӧ���ɵĺ�������������ʵ�����Ϊ1��1����÷�Ӧ�����ӷ���ʽ____��
![]() �������
�������![]() ��
��![]() ��
��![]() ������
������![]() ��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������
��NaOH��Һ��Ӧ�����Һ�У����ǵ����ʵ�������![]() ����ҺpH�Ĺ�ϵ��ͼ��ʾ��
����ҺpH�Ĺ�ϵ��ͼ��ʾ��
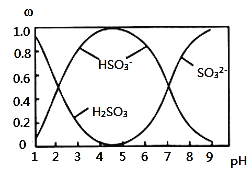
![]() ����˵������ȷ����______
����˵������ȷ����______![]() ����
����![]() ��
��
A.![]() ��Һ�еμ���ˮ����ʹ
��Һ�еμ���ˮ����ʹ![]() ��ֵ���
��ֵ���
B.![]() ʱ����Һ��
ʱ����Һ��![]()
C.![]() ʱ����Һ��
ʱ����Һ��![]()
D.��ͼ�����ݣ����Թ����![]() �ĵڶ�������ƽ�ⳣ��
�ĵڶ�������ƽ�ⳣ��![]()
E.��ͼ�����ݣ�![]() ��
��![]() ʱ����Һ��ˮ�ĵ���̶���ͬ
ʱ����Һ��ˮ�ĵ���̶���ͬ
![]() �����ð�ˮ���ն�����������ط�Ӧ����Ҫ�Ȼ�ѧ����ʽ���£�
�����ð�ˮ���ն�����������ط�Ӧ����Ҫ�Ȼ�ѧ����ʽ���£�
![]()
![]()
![]()
![]()
![]()
![]()
![]()
��Ӧ![]() ___
___![]() ��
��
![]() ȡװ�â��е�����ҺVmL����
ȡװ�â��е�����ҺVmL����![]() �����Ը��������Һ�ζ�������Һ��ҺӦװ��______
�����Ը��������Һ�ζ�������Һ��ҺӦװ��______![]() ������ʽ��������ʽ��
������ʽ��������ʽ��![]() �ζ����У��жϵζ��յ�ķ���______��
�ζ����У��жϵζ��յ�ķ���______��
![]() װ�â������֮һ������
װ�â������֮һ������![]() ����ԭ����ͼ��ʾ��ͼ��BΪ��Դ��______
����ԭ����ͼ��ʾ��ͼ��BΪ��Դ��______![]() ����������������
����������������![]() ������෴Ӧ���з�������Ҫ�缫��ӦʽΪ______��
������෴Ӧ���з�������Ҫ�缫��ӦʽΪ______��
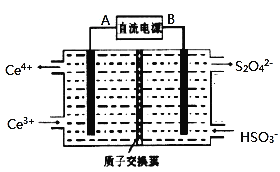
![]() ��֪����װ�â�����Һ��
��֪����װ�â�����Һ��![]() ��Ũ��Ϊ
��Ũ��Ϊ![]() ��Ҫʹ
��Ҫʹ![]() ����Һ�е�
����Һ�е�![]() ��ȫת��Ϊ
��ȫת��Ϊ![]() ���ù�����ת�Ƶ�����ĿΪ______��
���ù�����ת�Ƶ�����ĿΪ______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com