
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
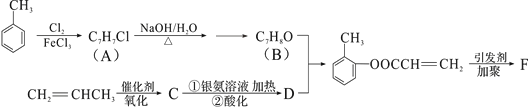
回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
【答案】 (酚)羟基 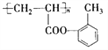 CH2=CHCHO + 2Ag(NH3)2OH
CH2=CHCHO + 2Ag(NH3)2OH![]() CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O ③⑤ 4
CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O ③⑤ 4 ![]() 取代反应
取代反应
【解析】甲苯与氯气发生取代反应生成A,A发生水解反应得到B,而B与D反应得到E,由E的结构可知,B为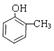 ,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO,E发生加聚反应生成F为
,D为CH2=CHCOOH,丙烯发生氧化反应得到C,C与银氨溶液反应得到丙烯酸,则C为CH2=CHCHO,E发生加聚反应生成F为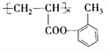 。
。
(1)化合物B为 ,含氧官能团名称是:羟基;F的结构简式为
,含氧官能团名称是:羟基;F的结构简式为 ;(2)C与银氨溶液共热的化学反应方程式为:CH2=CHCHO + 2Ag(NH3)2OH
;(2)C与银氨溶液共热的化学反应方程式为:CH2=CHCHO + 2Ag(NH3)2OH![]() CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O;(3)化合物D为CH2=CHCOOH,含有碳碳双键,可以发生加成反应、氧化反应,含有羧基,可以发生取代反应,不能发生消去反应、水解反应,故选③⑤;(4)化合物B为
CH2=CHCOONH4 + 2Ag↓+ 3NH3 + H2O;(3)化合物D为CH2=CHCOOH,含有碳碳双键,可以发生加成反应、氧化反应,含有羧基,可以发生取代反应,不能发生消去反应、水解反应,故选③⑤;(4)化合物B为 ,其同分异构体含苯环结构,羟基、甲基两个取代基的位置还有间位、对位两种,侧链可以为-OCH3或-CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢谱出现4组峰的有:
,其同分异构体含苯环结构,羟基、甲基两个取代基的位置还有间位、对位两种,侧链可以为-OCH3或-CH2OH,符合条件的同分异构体共有4种,其中核磁共振氢谱出现4组峰的有:![]() 、
、![]() ,其中不与FeCl3溶液发生显色反应的是
,其中不与FeCl3溶液发生显色反应的是![]() ;(5) B为
;(5) B为 ,D为CH2=CHCOOH,B与D发生反应生成
,D为CH2=CHCOOH,B与D发生反应生成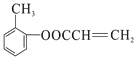 和水,其反应类型为取代反应。
和水,其反应类型为取代反应。


 名题训练系列答案
名题训练系列答案 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】(1)下面是石蜡油在炽热碎瓷片的作用下产生C2H4并检验C2H4性质的实验,完成下列各问题。
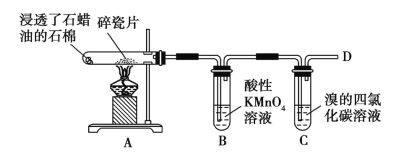
①B中溶液褪色,是因为乙烯被______________。
②C中发生反应的化学方程式为_________________________。
③在D处点燃时必须进行的操作是_____________。
(2)实验室制取的乙烯中常混有少量的SO2,有人设计如图实验装置以证明上述混合气体中含有乙烯和二氧化硫。试回答下列问题:
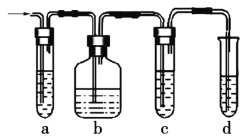
①图中a、b、c、d装置盛放的试剂依次是___(填序号)。
A.品红溶液
B.NaOH溶液
C.浓硫酸
D.酸性高锰酸钾溶液
②能说明SO2存在的实验现象是_____________。
③使用装置b的目的是_____________。
④使用装置c的目的是_____________。
⑤能证明混合气体中含有乙烯的现象是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土氧化物。平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2以及其他少量可溶于稀酸的物质)。某课题组以此粉末为原料回收铈,设计实验流程如下:
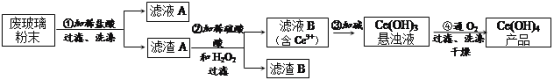
(1)洗涤滤渣A的目的是为了去除_______(填离子符号),检验该离子是否洗涤的方法是_________________________________________________________。
(2)第②步反应的离子方程式是______________________________,滤渣B的主要成分是_________。
(3)萃取是分离稀土元素的常用方法,已知化合物TBP作为萃取剂能将铈离子从水溶液中萃取出来,TBP________(填“能”或“不能”)与水互溶。实验室进行萃取操作是用到的主要玻璃仪器有_________、烧杯、玻璃棒、量筒等。
(4)取上述流程中得到的Ce(OH)4产品0.536g,加硫酸溶解后,用0.1000molL-1FeSO4标准溶液滴定终点是(铈被还原为Ce3+),消耗25.00mL标准溶液,该产品中Ce(OH)4的质量分数为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰水杨酸即阿司匹林是最常用的解热镇痛药,其结构如图所示。关于它的描述中不正确的是( )

A.分子式为C9H8O4
B.1mol 乙酰水杨酸最多可以与2molNaOH反应
C.1mol乙酰水杨酸最多可以与3molH2反应
D.其在酸性条件下水解产物遇氯化铁溶液可以呈现紫色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

(1)废铁渣进行“粉碎”的目的是_____。
(2)①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____。
②酸浸时,通入O2的目的是_____。
(3)滤渣的主要成分为____(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-![]() 被还原为Cr3+),该滴定反应的离子方程式为_____。
被还原为Cr3+),该滴定反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化学反应A2(g)+B2(g)═2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
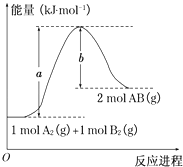
A.每生成2分子AB吸收b kJ热量
B.该反应热△H=+(a﹣b)kJmol﹣1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A﹣A和1 mol B﹣B键,放出a kJ能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_______(写出化学式)。
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为______(写出化学式)。 实验室过滤需用到的玻璃仪器有烧杯、__________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______。
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
实验序号 | I | II | III |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为_____。
②所用NaOH溶液的浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,等体积、pH均为3的HA和HB溶液分别加水稀释,溶液pH值的变化如下图所示,下列说法正确的是( )

A. 向HB溶液中滴加NaOH溶液的过程中,水的电离程度一直增大
B. 用pH为11的某碱与pH为3的HB溶液等体积混合后,溶液不可能显碱性
C. 氨水与HA溶液混合后的溶液中可能存在:c(NH4+ )>c(A+)>c(H+)>c(OH-)
D. 完全中和等体积等pH的HA、HB两溶液时,消耗同浓度NaOH溶液的体积:HA<HB
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表中离子方程式及其评价均合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO | 复分解反应,有沉淀生成,正确 |
C | 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
A.AB.BC.CD.D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com