
【题目】下表中离子方程式及其评价均合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO | 复分解反应,有沉淀生成,正确 |
C | 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
A.AB.BC.CD.D
【答案】C
【解析】
A.Fe2+具有还原性,HNO3具有氧化性,会发生氧化还原反应,离子方程式应为3FeO+NO3-+10H+=3Fe3++NO↑+5H2O,A错误;
B.除了Ba2+和SO32-反应生成沉淀,NH4+和OH-反应生成NH3·H2O,离子方程式应为Ba2++2OH-+SO32-+2NH4+=BaSO3↓+2NH3·H2O,B错误;
C.FeBr2溶液中,还原性Fe2+>Br-,因此通入Cl2,氯气先氧化Fe2+,再氧化Br-,氧化nmolFe2+,消耗![]() molCl2,剩余的
molCl2,剩余的![]() molCl2能氧化nmolBr-,离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,C正确;
molCl2能氧化nmolBr-,离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,C正确;
D.FeCl3溶液中加入KSCN溶液,能够发生反应,虽然没有气体、沉淀生成,但是生成的Fe(SCN)3是络合物,难电离,可以发生,评价错误,D错误;
答案选C。


科目:高中化学 来源: 题型:
【题目】[化学——选修5:有机化学基础]
有机物F是有机合成工业中一种重要的中间体。以甲苯和丙烯为起始原料合成F的工艺流程如下:
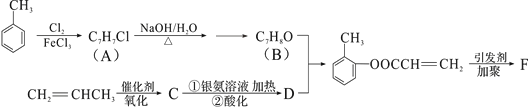
回答下列问题:
(1)化合物B中含氧官能团名称是_________F的结构简式__________________
(2)写出C与银氨溶液共热的化学反应方程式:_______________________
(3)化合物D不能发生的反应有__________________(填序号)。
①加成反应②取代反应③消去反应④氧化反应⑤水解反应
(4)B的含苯环结构的同分异构体还有__________种,其中一种的核磁共振氢谱中出现4个峰且不与FeCl3溶液发生显色反应的是____________(填结构简式)。
(5)B与D发生反应的类型________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积为2L的恒容密闭容器中加入![]() 和一定量的CO后,发生反应:
和一定量的CO后,发生反应:![]() ,CO和
,CO和![]()
![]() 的物质的量随时间的变化如下表表示:则下列说法错误的是( )
的物质的量随时间的变化如下表表示:则下列说法错误的是( )
| 0 | 3 | 10 | 12 |
| 2 | 1 |
|
|
| 0 | 1 |
|
|
A.在![]() 内,用
内,用![]() 表示的平均反应速率为
表示的平均反应速率为![]()
B.在该条件下,上述反应的平衡常数为3
C.反应达平衡时,![]()
![]() 的体积分数为
的体积分数为![]()
D.要增大反应速率且增大![]()
![]() 在混合物中的体积分数,可采用压缩体积,增大体系压强的措施
在混合物中的体积分数,可采用压缩体积,增大体系压强的措施
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.加入过量氨水,有白色沉淀生成,则原溶液一定有Al3+
B.加入NaHCO3溶液,产生白色沉淀,则原溶液-定有Al3+
C.加入盐酸酸化的BaCl2溶液,有白色沉淀生成,则原溶液一定有SO![]()
D.加入NaOH溶液,产生的气体能使湿润的红色石蕊试纸变蓝,则原溶液中一定有NH![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
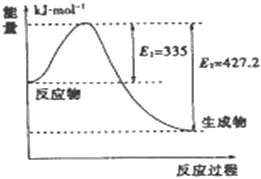
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______

A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作、现象和结论均正确的是( )
选项 | 实验操作 | 现象 | 结论 |
A | 向Na2SO4溶液中先加硝酸酸化,再加BaCl2溶液 | 无明显现象 | 不能用硝酸和BaCl2溶液检验SO |
B | 向AlCl3溶液中滴加过量氨水 | 溶液澄清 | AlCl3与NH3·H2O能大量共存 |
C | 将可调高度的铜丝伸入到稀HNO3中 | 溶液变蓝 | Cu与稀HNO3发生置换反应 |
D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,震荡,静置 | 下层溶液显紫红色 | 氧化性:Fe3+>I2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的![]() 、NO直接排放将对大气造成严重污染,利用电化学原理吸收
、NO直接排放将对大气造成严重污染,利用电化学原理吸收![]() 和NO,同时获得
和NO,同时获得![]() 和
和![]() 产品的工艺流程图如下
产品的工艺流程图如下![]() 为铈元素
为铈元素![]() 。
。
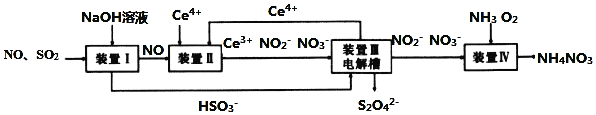
请回答下列问题.
![]() 若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
![]() 含硫各微粒
含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
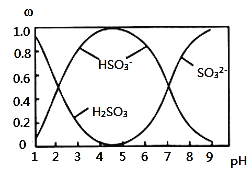
![]() 下列说法中正确的是______
下列说法中正确的是______![]() 填标号
填标号![]() 。
。
A.![]() 溶液中滴加氯水可以使
溶液中滴加氯水可以使![]() 的值变大
的值变大
B.![]() 时,溶液中
时,溶液中![]()
C.![]() 时的溶液中
时的溶液中![]()
D.由图中数据,可以估算出![]() 的第二级电离平衡常数
的第二级电离平衡常数![]()
E.由图中数据,![]() 和
和![]() 时的溶液中水的电离程度相同
时的溶液中水的电离程度相同
![]() 若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
反应![]() ___
___![]() 。
。
![]() 取装置Ⅰ中的吸收液VmL,用
取装置Ⅰ中的吸收液VmL,用![]() 的酸性高锰酸钾溶液滴定.吸收液溶液应装在______
的酸性高锰酸钾溶液滴定.吸收液溶液应装在______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中,判断滴定终点的方法______。
滴定管中,判断滴定终点的方法______。
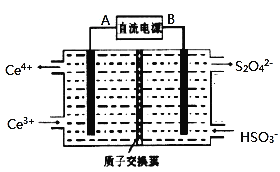
![]() 装置Ⅲ的作用之一是再生
装置Ⅲ的作用之一是再生![]() ,其原理如图所示,图中B为电源的______
,其原理如图所示,图中B为电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,左侧反应室中发生的主要电极反应式为______。
极,左侧反应室中发生的主要电极反应式为______。
![]() 已知进入装置Ⅳ的溶液中
已知进入装置Ⅳ的溶液中![]() 的浓度为
的浓度为![]() ,要使
,要使![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,该过程中转移电子数目为______。
,该过程中转移电子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以菱镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]()
![]() 为原料制备高纯氧化镁的实验流程如下:
为原料制备高纯氧化镁的实验流程如下:

![]() 滤液P中含有的阳离子有 ______。
滤液P中含有的阳离子有 ______。
![]() 过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
![]() 已知:
已知:
|
|
| |
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
过程Ⅲ中加入![]() 调节溶液pH约为4,其目的是 ______ 。
调节溶液pH约为4,其目的是 ______ 。
![]() 过程Ⅳ在
过程Ⅳ在![]() 煅烧
煅烧![]() ,发生多个反应,产物除MgO外,还有
,发生多个反应,产物除MgO外,还有![]() 、
、![]() 、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
![]() 中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
![]() 中盛放的溶液是
中盛放的溶液是![]() 填字母
填字母![]() ______ 。
______ 。
![]() 溶液
溶液![]() 溶液
溶液 ![]() 稀硝酸
稀硝酸![]() 溶液
溶液
![]() 写出
写出![]() 煅烧
煅烧![]() ,产生气体产物是S和CO的化学方程式 ______ 。
,产生气体产物是S和CO的化学方程式 ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是

A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com