
【题目】将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是
CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是

A. 0.5 mol·L-1·min-1B. 0.1 mol·L-1·min-1
C. 0 mol·L-1·min-1D. 0.125 mol·L-1·min-1
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:
【题目】实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是

选项 | a中的物质 | b中的物质 | c中收集的气体 | d中的物质 |
A | 浓氨水 | CaO | NH3 | H2O |
B | 浓硫酸 | Na2SO3 | SO2 | NaOH溶液 |
C | 稀硝酸 | Cu | NO2 | H2O |
D | 浓盐酸 | MnO2 | Cl2 | NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己烯常用于有机合成。现通过下列流程,以环己烯为原料合成环醚、聚酯、橡胶,其中 F 可以作内燃机的抗冻剂,J 分子中无饱和碳原子。已知:R1—CH==CH—R2→R1—CHO+R2—CHO
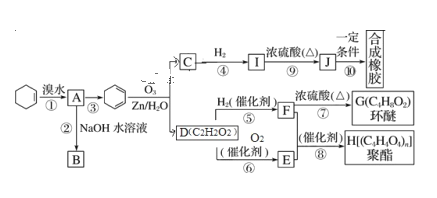
(1)A的结构简式为_____③的反应试剂及条件是______
(2)有机物B和 I的关系为_____(填字母)。
A.同系物 B.同分异构体 C.都属于醇类 D.都属于烃
(3)H的名称_________
(4)写出下列反应的化学方程式并注明反应类型:
反应⑨_________;________
(5)写出两种C的属于酯类的链状同分异构体的结构简式:_________;________
(6)参照题给信息,试写出以 2-丁烯为原料制取乙酸乙酯的合成路线流程图(无机原料任选)
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚硅酸铁是目前无机高分子絮凝剂研究的热点,一种用钢管厂的废铁渣(主要成分Fe3O4,含少量碳及二氧化硅)为原料制备的流程如下:

(1)废铁渣进行“粉碎”的目的是_____。
(2)①加热条件下酸浸时,Fe3O4与硫酸反应的化学方程式为_____。
②酸浸时,通入O2的目的是_____。
(3)滤渣的主要成分为____(填化学式)。
(4)“Fe3+浓度检测”是先用SnCl2将Fe3+还原为Fe2+;在酸性条件下,再用K2Cr2O7标准溶液滴定Fe2+(Cr2O72-![]() 被还原为Cr3+),该滴定反应的离子方程式为_____。
被还原为Cr3+),该滴定反应的离子方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验装置正确且能达到实验目的的是
|
|
A.证明非金属性氯>碳>硅(A、B、D中的试剂分别为盐酸、石灰石和硅酸钠溶液) | B.石油分馏 |
|
|
C.用KMnO4 与浓盐酸反应制取适量氯气的 简易装置 | D.实验室制乙酸乙酯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是从铝士矿(主要成分为Al2O3,还含有少量SiO2、Fe2O3等杂质)中提取Al2O3并生产AlN的工艺流程:

(1)“溶解”时,溶液中的硅酸钠与偏铝酸钠发生反应:2Na2SiO3+2NaAlO2+2H2O=Na2Al2Si2O8↓+4NaOH,赤泥的主要成分为_______(写出化学式)。
(2)“酸化”时通入过量CO2与NaAlO2反应生成Al(OH)3,滤液的主要成分为______(写出化学式)。 实验室过滤需用到的玻璃仪器有烧杯、__________、玻璃棒。
(3)“还原”时,炭黑在高温下被氧化为CO,反应的化学方程式为_______。
(4)现取三份不同质量的氮化铝样品(假设杂质只含有炭黑)分别加到20.00 mL相同浓度的NaOH溶液中,充分反应后,测得实验数据如下表所示。(已知:AlN+NaOH+H2O=NaAlO2+NH3↑)
实验序号 | I | II | III |
加入氮化铝样品的质量/g | 4.1 | 8.2 | 12.3 |
生成氨气的体积/L(标准状况) | 1.456 | 2.912 | 4.256 |
①该样品中AlN的质量分数为_____。
②所用NaOH溶液的浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2 L的密闭容器中发生反应xA(g)+yB(g)![]() zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
zC(g)。图甲表示200 ℃时容器中A、B、C物质的量随时间的变化,图乙表示不同温度下平衡时C的体积分数随起始n(A)∶n(B)的变化关系。则下列结论正确的是( )
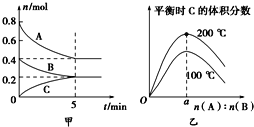
A. 200℃时,反应从开始到平衡的平均速率v(B)=0.04 mol·L-1·min-1
B. 200℃时,该反应的平衡常数为25
C. 当外界条件由200℃降温到100℃,原平衡一定被破坏,且正逆反应速率均增大
D. 由图乙可知,反应xA(g)+yB(g)![]() zC(g)的△H<0,且a=2
zC(g)的△H<0,且a=2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于碱金属元素的说法正确的是( )
①原子结构的相同点是最外层电子数相同,都为1
②原子结构的不同点是随核电荷数的增加,电子层数增多,原子半径增大
③具有相似的化学性质,都是活泼金属
④都具有强还原性,在化合物中显![]() 价
价
⑤化学性质有差别,从Li到Cs,失电子能力逐渐增强
A.①③④B.①③⑤C.②④⑤D.①②③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体血液里Ca2+的浓度一般采用mgcm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制100mLKMnO4标准溶液的过程示意图。
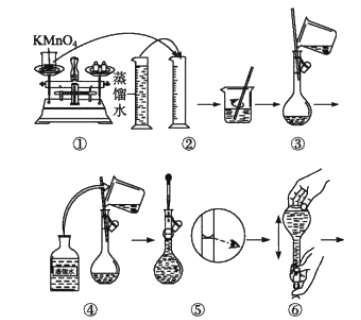
(1)根据图示判断,其中不正确的操作有___(填序号)。
(2)其中确定100mL溶液体积的容器是___(填名称)。
(3)如果忘记洗涤烧杯,所配制的溶液浓度将___;如果定容时仰视,所配制的溶液浓度将___(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样40.00mL,经过上述处理后得到草酸,再用0.020molL-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗24.00mLKMnO4溶液。
(4)请书写草酸与KMnO4溶液反应的离子方程式:___。
(5)经过计算,血液样品中Ca2+的浓度为___mgcm-3。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com