
【题目】人体血液里Ca2+的浓度一般采用mgcm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制100mLKMnO4标准溶液的过程示意图。
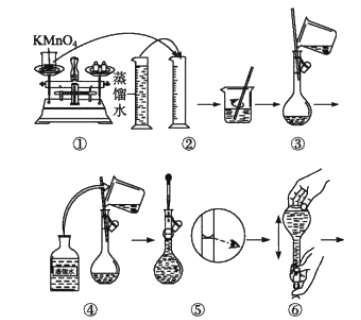
(1)根据图示判断,其中不正确的操作有___(填序号)。
(2)其中确定100mL溶液体积的容器是___(填名称)。
(3)如果忘记洗涤烧杯,所配制的溶液浓度将___;如果定容时仰视,所配制的溶液浓度将___(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样40.00mL,经过上述处理后得到草酸,再用0.020molL-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗24.00mLKMnO4溶液。
(4)请书写草酸与KMnO4溶液反应的离子方程式:___。
(5)经过计算,血液样品中Ca2+的浓度为___mgcm-3。
【答案】②⑤ 100mL容量瓶 偏小 偏小 2MnO![]() +5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 1.2
+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 1.2
【解析】
根据配制一定物质的量浓度的基本操作分析判断,误差分析紧扣c=![]() 判断即可,根据得失电子守恒、原子守恒和电荷守恒书写离子方程式,用关系式法计算。
判断即可,根据得失电子守恒、原子守恒和电荷守恒书写离子方程式,用关系式法计算。
(1)量筒只能量取溶液,不能稀释或溶解药品;定容时,视线要与凹液面最低处相切,所以错误为②⑤;
(2)配制100mL溶液需要100mL容量瓶,所以确定100mL溶液体积的仪器是100mL容量瓶,故答案为:100 mL容量瓶;
(3)根据c=![]() 判断误差,若忘记洗涤烧杯,容量瓶内溶质物质的量偏小,则所配制的溶液浓度将偏小;如果定容时仰视,溶液体积偏大,所配制的溶液浓度将偏小;
判断误差,若忘记洗涤烧杯,容量瓶内溶质物质的量偏小,则所配制的溶液浓度将偏小;如果定容时仰视,溶液体积偏大,所配制的溶液浓度将偏小;
(4)草酸具有还原性,高锰酸钾具有强氧化性,二者发生氧化还原反应生成锰离子、二氧化碳和水,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为2MnO4-+5H2C2O4+6H+═2 Mn2++10CO2↑+8H2O;
(5)关系式为5Ca2+~5C2O42-~2MnO4-,设钙离子的质量为xg,已知滴定消耗24.00mL0.020molL-1KMnO4溶液,其物质的量为0.020molL-1×0.024L=4.8×10-4mol,则![]() =4.8×10-4mol×
=4.8×10-4mol×![]() ,解得:x=0.048,钙离子浓度=
,解得:x=0.048,钙离子浓度=![]() =1.2 mgcm-3。
=1.2 mgcm-3。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】将6 mol CO2和8 mol H2充入一容积为2 L的密闭容器中(温度保持不变)发生反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是
CH3OH(g)+H2O(g) ΔH<0。测得H2的物质的量随时间变化如图所示(图中字母后的数字表示对应的坐标)。该反应在8~10 min内CO2的平均反应速率是

A. 0.5 mol·L-1·min-1B. 0.1 mol·L-1·min-1
C. 0 mol·L-1·min-1D. 0.125 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z在周期表中位置关系如图所示
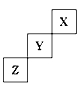
(1)X元素的名称是___________。
(2)Y在元素周期表中的位置是__________,它形成单质的化学式是_________。
(3)Z元素的原子结构示意图为__________。写出Z单质与铁反应的化学反应方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
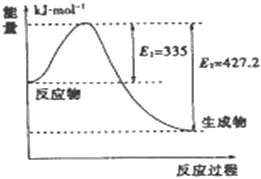
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______

A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无水氯化铝在生产、生活中应用广泛。
(1)氯化铝在水中形成具有净水作用的氢氧化铝胶体,其反应的离子方程式为___________。
(2)工业上用铝土矿(主要成分为Al2O3,含有Fe2O3 、SiO2等杂质)制取无水氯化铝的一种工艺流程示意如下:
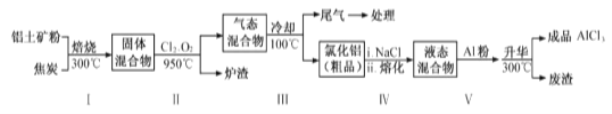
已知:

①步骤Ⅰ中焙烧使固体水分挥发、气孔数目增多,其作用是_____(只要求写出一种)。
②步骤Ⅱ中若不通入氯气和氧气,则反应生成相对原子质量比硅大的单质是_____。
③步骤Ⅲ的尾气经冷却至室温后,气体用足量的NaOH冷溶液吸收,生成的盐主要有3种,其化学式分别为_________________________。
④结合流程及相关数据分析,步骤Ⅴ中加入铝粉的目的是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业生产中产生的![]() 、NO直接排放将对大气造成严重污染,利用电化学原理吸收
、NO直接排放将对大气造成严重污染,利用电化学原理吸收![]() 和NO,同时获得
和NO,同时获得![]() 和
和![]() 产品的工艺流程图如下
产品的工艺流程图如下![]() 为铈元素
为铈元素![]() 。
。
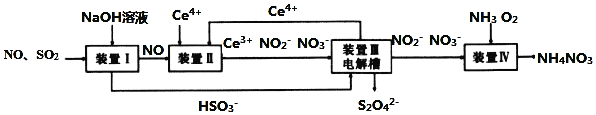
请回答下列问题.
![]() 若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
若装置Ⅱ中反应生成的含氮化合物的物质的量比为1:1,则该反应的离子方程式____。
![]() 含硫各微粒
含硫各微粒![]() 、
、![]() 和
和![]() 存在于
存在于![]() 与NaOH溶液反应后的溶液中,它们的物质的量分数
与NaOH溶液反应后的溶液中,它们的物质的量分数![]() 与溶液pH的关系如图所示。
与溶液pH的关系如图所示。
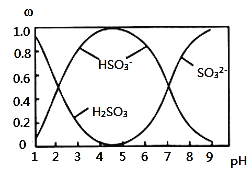
![]() 下列说法中正确的是______
下列说法中正确的是______![]() 填标号
填标号![]() 。
。
A.![]() 溶液中滴加氯水可以使
溶液中滴加氯水可以使![]() 的值变大
的值变大
B.![]() 时,溶液中
时,溶液中![]()
C.![]() 时的溶液中
时的溶液中![]()
D.由图中数据,可以估算出![]() 的第二级电离平衡常数
的第二级电离平衡常数![]()
E.由图中数据,![]() 和
和![]() 时的溶液中水的电离程度相同
时的溶液中水的电离程度相同
![]() 若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
若利用氨水吸收二氧化硫,其相关反应的主要热化学方程式如下:
![]()
![]()
![]()
![]()
![]()
![]()
![]()
反应![]() ___
___![]() 。
。
![]() 取装置Ⅰ中的吸收液VmL,用
取装置Ⅰ中的吸收液VmL,用![]() 的酸性高锰酸钾溶液滴定.吸收液溶液应装在______
的酸性高锰酸钾溶液滴定.吸收液溶液应装在______![]() 填“酸式”或“碱式”
填“酸式”或“碱式”![]() 滴定管中,判断滴定终点的方法______。
滴定管中,判断滴定终点的方法______。
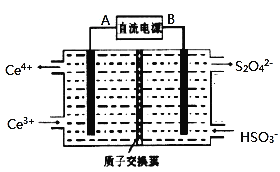
![]() 装置Ⅲ的作用之一是再生
装置Ⅲ的作用之一是再生![]() ,其原理如图所示,图中B为电源的______
,其原理如图所示,图中B为电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,左侧反应室中发生的主要电极反应式为______。
极,左侧反应室中发生的主要电极反应式为______。
![]() 已知进入装置Ⅳ的溶液中
已知进入装置Ⅳ的溶液中![]() 的浓度为
的浓度为![]() ,要使
,要使![]() 该溶液中的
该溶液中的![]() 完全转化为
完全转化为![]() ,该过程中转移电子数目为______。
,该过程中转移电子数目为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素 X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。下列说法正确的是
A. 原子半径:r(W) > r(Z) > r(Y)
B. 由X、Y 组成的化合物中均不含共价键
C. Y 的最高价氧化物的水化物的碱性比Z的弱
D. X 的简单气态氢化物的热稳定性比W的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是

A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2(g)+Cl2(g)=2HCl(g) ΔH= -184.6kJ/mol,则![]() H2(g)+
H2(g)+![]() Cl2(g)=HCl(g)的ΔH为( )
Cl2(g)=HCl(g)的ΔH为( )
A.+184.6kJ/molB.-92.3kJ/molC.-369.2kJ/molD.+92.3kJ/mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com