
【题目】根据下列实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结 论 |
A | 含有酚酞的Na2CO3溶液中加入少量BaCl2固体,溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
B | 用铂丝蘸取少量NaCl溶液进行焰色反应,火焰呈黄色 | 这是钠离子的发射光谱 |
C | NaI溶液 | 酸性条件下H2O2的氧化性比I2强 |
D | 向浓度均为0.1 mol·L-1的NaCl和NaI混合溶液中滴加少量AgNO3溶液,先出现黄色沉淀 | Ksp(AgCl)<Ksp(AgI) |
A.AB.BC.CD.D
【答案】AB
【解析】
A.Na2CO3溶液水解呈碱性,加入氯化钡使水解平衡逆向移动,则由溶液颜色的变化可知Na2CO3溶液中存在水解平衡,故A正确;
B.钠元素的焰色反应为黄色,当碱金属及其盐在火焰上灼烧时,原子中的电子吸收了能量,从能量较低的轨道跃迁到能量较高的轨道,但处于能量较高轨道上的电子是不稳定的,很快跃迁回能量较低的轨道,这时就将多余的能量以光的形式放出。而放出的光的波长在可见光范围内(波长为400nm~760nm),因而能使火焰呈现颜色,这是钠离子的发射光谱,故B正确;
C.过氧化氢、硝酸均可氧化碘离子,不能比较其氧化性,应选盐酸,故C错误;
D.二者为同类型难溶物,溶液中先生成AgI沉淀,说明AgI更难溶,因此溶度积大小关系为:Ksp(AgCl)>Ksp(AgI),故D错误;
故答案为:AB。


科目:高中化学 来源: 题型:
【题目】2019年12月20日,美国总统特朗普签署了2020财政年度国防授权法案,对俄罗斯向欧洲进行天然气输出的“北溪2号”管道项目实施制裁,实施“美国优先发展战略”。天然气既是一种优质能源,又是一种重要化工原料,甲烧水蒸气催化重整制备高纯氢是目前的研究热点。
(1)甲烷水蒸气催化重整是制备高纯氢的方法之一,已知在反应器中存在如下反应过程:
Ⅰ.![]()
Ⅱ.![]()
根据上述信息请写出甲烷水蒸气催化重整的热化学反方程式:________________。
(2)在一定条件下向a、b两个恒温恒容的密闭容器中均通入![]() 和
和![]() ,利用反应Ⅰ制备
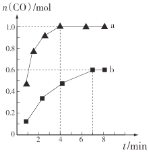
,利用反应Ⅰ制备![]() ,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
,测得两容器中CO的物质的量随时间的变化曲线分别为a和b(已知容器a、b的体积为2 L)。
则a、b两容器的温度________(填“相同”“不相同”或“不确定”);在达到平衡前,容器a的压强________(填“逐渐增大”“不变”或“逐渐减小”);容器a中![]() 从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
从反应开始到恰好平衡时的平均反应速率为________,在该温度下反应的化学平衡常数K=________。
(3)某氢氧燃料电池以熔融态的碳酸盐为电解质,其中![]() 参与电极反应。工作时负极的电极反应为
参与电极反应。工作时负极的电极反应为![]() 。如图所示,根据相关信息回答下列问题:
。如图所示,根据相关信息回答下列问题:
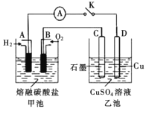
①正极的电极反应为________;
②当甲池中A电极理论上消耗![]() 的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
的体积为448 mL(标准状况)时,乙池中C、D两电极质量变化量之差为________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,水溶液中H+和OH-的浓度变化曲线如图。下列说法正确的是( )

A.升高温度,可能引起由c向b的变化
B.该温度下,水的离子积常数为1.0×10-13
C.该温度下,加入FeCl3可能引起由b向a的变化
D.该温度下,稀释溶液可能引起由c向d的变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫的化合物在生产、生活中有广泛应用,其吸收和处理也十分重要。完成下列填空:
(1)SO2具有还原性,可以和许多氧化剂反应。SO2气体通入硫酸酸化的K2Cr2O7溶液中恰好生成铬钾矾[KCr(SO4)2·12H2O]。写出该反应的化学方程式_____________,反应中被还原的元素是__________。
(2)过量的SO2通入Na2S溶液,写出有关的离子方程式____________。
(3)在1L 0.3mol/L的NaOH溶液中,通入4.48LSO2(标况),反应后所得溶液中微粒的浓度之间有一些等量关系,例如:c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),请再写出两个等量关系:_______
(4)在室温下,下列曲线可以描述乙酸(甲、Ki=1.8×10﹣5)和次氯酸(乙、Ki=2.95×10﹣8)在水中的电离度与浓度关系的是_________。
A.
B.
C.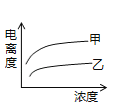
D.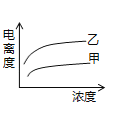
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相容性方面有很好的应用前景. PPG的一种合成路线如下:
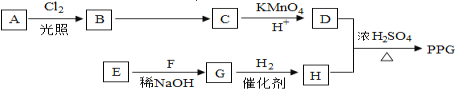
已知:
①烃A的相对分子质量为70,其一氯代物只有一种。
②化合物B为一氯代烃,化合物C的分子式为C5H8。
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质。
④R1CHO+R2CH2CHO
⑤R1CH2=CH2R2 →R1COOH+R2COOH
回答下列问题:
(1)A的结构简式为________________________________。
(2)B到C的反应条件________________________________。
(3)由E和F生成G的化学方程式为________________________,反应类型_________。
(4)由D和H生成PPG的化学方程式为___________________。
(5)写出D的最简同系物和H按1:1反应的产物______________________。
(6)写出G和新制的氢氧化铜溶液反应的化学方程式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型纳米材料MFe2Ox(3<x<4)中M表示+2价的金属元素,在反应中化合价不变化.常温下,MFe2Ox能使工业废气中的SO2转化为S,转化过程表示如图.下列说法正确的是( )
![]()
A.x<yB.SO2是该反应的催化剂
C.MFe2Ox是还原剂D.氧化性:MFe2Oy>SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(N2H4)是一种绿色环保的还原剂,其氧化产物为氮气。
(1) 合成联氨的有关反应如下:
NH3(g)+NaClO(aq)=NH2Cl(l)+NaOH(aq) ΔH1=-67.45 kJ·mol-1
NH2Cl(l)+NaOH(aq)+NH3(g)=N2H4(l)+NaCl(aq)+H2O(l) ΔH2=-195.32 kJ·mol-1
反应2NH3(g)+NaClO(aq)=N2H4(l)+NaCl(aq)+H2O(l) ΔH=________kJ·mol-1。
(2) 联氨为二元弱碱,在水中的电离方式与氨相似,写出联氨与过量盐酸反应的离子方程式:________。
(3) 联氨—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。该电池放电时,负极的电极反应式是__________。
(4) 若用此碱性燃料电池作电源,电解AgNO3溶液,电解方程式为_________;若阴极析出5.40g金属银,则联氨—空气燃料电池中至少通入标准状况下空气体积________mL(假设空气中氧气体积分数为20%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸的工业制备包括氨的合成、氨的催化氧化及硝酸的浓缩等过程.完成下列计算:
(1)采用甲烷的二次转化法可以制备氢气.
第一次转化的化学方程式:CH4+H2O→CO+3H2;
第二次转化的化学方程式:2CO+CH4+2O2→3CO2+2H2;2CO+O2→2CO2.
现有标准状况下1m3的甲烷,若第一次转化80%,第二次转化20%,经过二次完全转化后可以得到H2__mol.
(2)用饱和K2CO3溶液吸收上述混合气体中的CO2以得到纯净的氢气.处理上述的CO2至少需要饱和K2CO3溶液____g.(已知:20℃K2CO3溶解度:110g/100g水)
(3)已知NH3+2O2→HNO3+H2O.现有氨气1.7吨,不补充水,理论上可制得硝酸的浓度为___%;在该硝酸中加入__吨水最终可得50%的硝酸.
(4)工业上常用98%的浓H2SO4作为制取浓HNO3的脱水剂.63.5%HNO3(质量为M1)中加98%的浓H2SO4(质量为M2)后蒸馏.分别得到97.7%的HNO3和49%的H2SO4溶液(不含HNO3).
①若蒸馏过程中HNO3、H2SO4、H2O均无损耗,求蒸馏前的投料比![]() 的值__(列式计算).
的值__(列式计算).
②蒸馏过程中,若H2O的损耗占总质量的5.0%,即有(M1+M2)×5.0%的H2O流失.则投料时,![]() 比值如何变化,请列式计算说明__.
比值如何变化,请列式计算说明__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氮氮双键不能与Br2发生加成反应。苏丹红是很多国家禁止用于食品生产的合成色素,结构简式如图所示。下列关于苏丹红的说法中错误的是( )
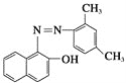
A.苏丹红属于芳香族化合物B.苏丹红能与FeCl3溶液发生显色反应
C.苏丹红能被酸性KMnO4溶液氧化D.1 mol苏丹红最多可与1 mol Br2发生取代反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com