
【题目】某溶液中含有两种溶质NaCl和H2SO4 , 物质的量之比为3:1.用石墨作电极电解溶液,根据电极产物,可明显分为三个阶段.下列叙述不正确的是( )
A.阴极只析出H2
B.阳极先析出Cl2 , 后析出O2
C.电解最后阶段为电解水
D.溶液pH不断增大,最后为7
【答案】D
【解析】解:可以将溶质看成3molNaCl和1molH2SO4,再转化一下思想,可以看成2molHCl,1molNa2SO4,1molNaCl,由于1molNa2SO4自始至终无法放电,且其溶液pH=7,暂时可以忽略,则电解过程可先看成电解HCl,再电解NaCl,最后电解水,
即2HCl ![]() H2↑+Cl2↑,2NaCl+2H2O
H2↑+Cl2↑,2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,2H2O
2NaOH+H2↑+Cl2↑,2H2O ![]() 2H2↑+O2↑,生成的NaOH为碱性,pH大于7.
2H2↑+O2↑,生成的NaOH为碱性,pH大于7.
A、阴极自始自终是氢离子放电,只析出H2,故A正确;
B、阳极氯离子先于氢氧根离子放电,先析出Cl2,后析出O2,故B正确;
C、电解最后阶段为电解水,故C正确;
D、溶液pH不断增大,最后生成的NaOH为碱性,pH大于7,故D错误;
故选D.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】在化学反应中,只有极少数分子的能量比所有分子的平均能量高得多,只有这些高能量的分子发生碰撞时才可能发生化学反应,人们把这些高能量的分子称为活化分子,其他分子成为普通分子.把活化分子的平均能量与反应物分子的平均能量之间的差值叫活化能,单位为kJ/mol.请认真观察如图后回答问题. 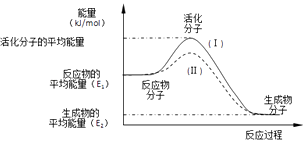
(1)图中所示的反应是(填“吸热”或“放热”)反应,该反应的△H=kJ/mol(用含E1、E2的代数式表示).
(2)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能明显降低,活化分子百分数增多,反应速率加快,你认为最有可能的原因是 .
(3)0.01mol甲苯(分子式为C7H8 , 常温下为液态)在足量的O2中燃烧,生成CO2气体和液态水,放出39.43kJ的热量.该反应的热化学方程式为: .
(4)将煤转化为水煤气(CO和H2的混合气体)是通过化学方法将煤转化为洁净燃料的方法之一.煤转化为水煤气的主要化学反应为:C(s)+H2O(g)═CO(g)+H2(g);焓变为△H1 . 已知:①2H2(g)+O2(g)═2H2O(g);△H2=﹣483.6kJ/mol
②2C(s)+O2(g)═2CO(g);△H3=﹣221.0kJ/mol结合上述热化学方程式计算得出△H1=kJ/mol
(5)计算△H1时所用到的基本化学规律叫做定律.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃、101kPa时,有以下能量转化图,下列说法不正确的是( )
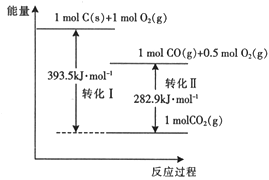
A. 转化Ⅱ的热化学方程式2CO(g)+O2(g)=2CO2(g) △H=-282.9 kJ·mol-1
B. 相同条件下,1mol C(s )和0.5 mol O2(g)总能量高于1mol CO(g)的能量
C. 由C→CO 的热化学方程式2C(s)+O2(g)=2CO(g) △H=-221.2 kJ·mol-1
D. CO2(g)分解为C(s)和O2(g)是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在好氧菌和厌氧菌作用下,废液中NH4+能转化为N2(g)和H2O(1),示意图如下:

反应I ![]()
反应Ⅱ![]()
下列说法正确的是
A. 两池发生的反应中,氮元素只被氧化
B. 两池中投放的废液体积相等时,NH4+能完全转化为N2
C. 常温常压下,反应Ⅱ中生成22.4LN2转移的电子数为3.75×6 02×1023
D. ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知固体A受热易分解,实验流程和结果如下:

B和C为常见气体且所含元素相同。气体C在标准状况下密度为1.96g·L-1。请回答:
(1)白色沉淀的化学式___________________。
(2)写出A受热分解的化学方程式___________________。
(3)取少量固体D溶于稀硫酸,加入适量的KI溶液,反应后溶液显棕黄色,同时产生一种白色的碘化物沉淀。写出产生该现象的离子方程式___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组要完成中和热的测定实验.
(1)实验桌上备有烧杯(大、小两个烧杯)、泡沫塑料、泡沫塑料板、胶头滴管、量筒、稀盐酸(0.5molL﹣1)、稀 NaOH溶液(0.55molL﹣1),尚缺少的实验玻璃用品是、 .
(2)写出表示稀盐酸和稀氢氧化钠溶液反应中和热的热化学方程式(中和热为57.3kJmol﹣1): .
(3)若用稀醋酸、稀硫酸、浓硫酸分别和稀氢氧化钠溶液反应来测定中和热,恰好完全反应时对应的热效应分别为△H1、△H2、△H3的大小关系是 .
(4)每组实验所用氢氧化钠溶液和稀盐酸的体积均为 50mL,可近似认为该实验中稀盐酸和稀氢氧化钠溶液的密度均为 1g/cm3,中和后生成溶液的比热容c=4.18J/(g℃),实验中记录数据如表所示,请填写表中空白:
编号 | 起始温度T1/℃ | 终止温度T2/℃ | 平均温度差T2﹣T1/℃ | △H | ||
盐酸 | NaOH | 平均值 | ||||
① | 26.2 | 26.0 | 26.1 | 29.2 |
|
|
② | 25.9 | 25.9 | 25.9 | 29.2 | ||
③ | 26.4 | 26.2 | 26.3 | 29.5 | ||
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对现行的元素周期表的说法中正确的是( )
A.元素周期表是按相对原子质量逐渐增大的顺序从左到右排列的
B.最外层电子数相同的元素都是同一族
C.同族元素的最外层电子数一定相同
D.同周期元素的电子层数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道,法国里昂的科学家最近发现一种只由四个中子构成的粒子,这种粒子称为“四中子”,也有人称之为“零号元素”。下列有关“四中子”粒子的说法不正确的是
A.该粒子不显电性B.该粒子质量比氢原子大
C.该粒子质量数为4D.在周期表中与氢元素占同一位置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com