
【题目】16.8gFe跟一定量浓 HNO3 反应,Fe 全部溶解,共收集NO、NO2的总体积为 11.2 L(标准状况),所得溶液中 H+的物质的量为0.02mol,请回答:
(1)反应中被还原的硝酸为_______mol。
(2)生成的 NO 与 NO2 的物质的量之比为______。
(3)写出该反应的离子方程式:______。
【答案】0.5 2:3 3Fe +14H++5NO3 -===3Fe3++2NO2↑+3NO↑+7H2O
【解析】
16.8gFe跟一定量浓 HNO3 反应,Fe 全部溶解,所得溶液中 H+的物质的量为0.02mol,说明硝酸有剩余,铁全部被氧化物Fe3+;硝酸被还原为NO、NO2;根据得失电子守恒计算NO 与 NO2 的物质的量之比。
(1)硝酸被还原为NO、NO2,根据氮元素守恒,被还原的硝酸的物质的量等于NO、NO2的物质的量,所以被还原的硝酸的物质的量=![]() 0.5mol;
0.5mol;
(2)设生成的 NO的物质的量是 xmol,则NO2 的物质的量(0.5-x) mol;根据得失电子守恒![]() ,x=0.2mol,所以NO、NO2的物质的量分别是0.2mol、0.3mol,生成的 NO 与 NO2 的物质的量之比为2:3;
,x=0.2mol,所以NO、NO2的物质的量分别是0.2mol、0.3mol,生成的 NO 与 NO2 的物质的量之比为2:3;
(3)生成的 NO 与 NO2 的物质的量之比为2:3,根据得失电子守恒配平方程式,该反应的离子方程式是3Fe +14H++5NO3 -===3Fe3++2NO2↑+3NO↑+7H2O。


科目:高中化学 来源: 题型:
【题目】今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe2+、Mg2+、Ba2+、NH4+、Cl-、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加过量NaOH溶液加热后,只收集到气体0.02mol,无沉淀生成,同时得到溶液甲。
②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02g。
③第二份加足量BaCl2溶液后,得白色沉淀,加盐酸不溶解,经过滤、洗涤、干燥后,称得沉淀质量为13.98g。
(1)由上述实验可确定溶液中一定不存在的离子是______________,不能确定是否存在的离子是_______,检验该离子需使用何种试剂或方法______________。
(2)由题意可知此溶液呈________性(答酸性、碱性或中性),上述金属离子中既能被氧化又能被还原的离子是___________。
(3)钾离子是否存在(是或否):_______,若存在其浓度范围为(没有则不答):_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组同学利用下图所示装置(夹持及加热装置已略去,装置气密性良好)探究SO2的性质(实验前已事先除去装置中的空气)。请回答下列问题:
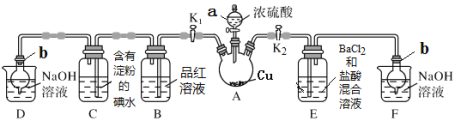
[查阅资料得知浓硫酸的沸点为338 ℃,酒精灯火焰的温度为400~500 ℃]
(1)仪器a的名称_________。
(2)装置D和F的作用是_________。
(3)加热时,装置A中反应的化学方程式为________。
(4)打开K1,关闭K2,加热装置A一段时间后,B中的现象是_____,当装置C中溶液由蓝色变为无色,由此推测所得无色溶液中的离子主要是H+、I- 和____;为了进一步实验证实了该过程中SO2已被氧化,该实验操作及现象是:_____。
(5)关闭K1,打开K2,用酒精灯加热装置A,观察到E中发生的现象是:有白色沉淀产生,白色沉淀的成分是_____,生成白色沉淀的原因可能是___(选填字母序号)。
a.SO2与BaCl2溶液反应生成了白色沉淀
b.BaCl2溶液与硫酸蒸气反应生成了白色沉淀
c.SO2溶于水生成的H2SO3被装置内的O2氧化生成H2SO4,再与BaCl2反应生成白色沉淀
(6)取A中产生的SO2气体通入足量双氧水中,然后加入足量BaCl2溶液,经过滤、洗涤、干燥得到4.66 g沉淀。据此推知SO2气体的体积为___mL(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(s)+2B(g)===C(g)+D(g),在一体积可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A. 增加B的浓度
B. 将容器的体积缩小一半
C. 保持压强不变,充入He使容器体积增大
D. 保持体积不变,充入He使体系压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.新制氯水能使品红溶液褪色,说明Cl2具有漂白性
B.富含硫单质的矿物在工业上可用于制造硫酸
C.硫粉在过量的纯氧中燃烧可以生成大量的SO3
D.常温时将Fe片放入浓硫酸,无明显现象是因为Fe和浓硫酸不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素形成的酸有硝酸、亚硝酸(HNO2)等,其中HNO2为一元弱酸。
(1)写出HNO2溶液与NaOH溶液反应的离子方程式:______;
(2)亚硝酸钠(NaNO2)像食盐一样有咸味,但有很强的毒性,误食NaNO2会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2 + 4HI ═ 2NO↑ + 2NaI + I2 + 2H2O,该反应被氧化的元素是______,
(3)实验室需配制0.1molL﹣1的NH4NO3溶液500mL。
①配制时,应用托盘天平称取NH4NO3的质量为_______;
②定容时俯视刻度线,所配得溶液的浓度________(填“偏高”、“偏低”或“无影响”);
(4)在浓硝酸中放入铜片:若将12.8 g铜跟一定量的浓硝酸反应,铜消耗完时,共产生5.6 L(标准状况)气体,则所消耗的HNO3的物质的量为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝酸是氧化性酸,其本质是NO3-有氧化性,某课外实验小组进行了下列有关NO3-氧化性的探究(实验均在通风橱中完成)。
实验装置 | 编号 | 溶液X | 实验现象 |
| 实验Ⅰ | 6 mol·L-1稀硝酸 | 电流计指针向右偏转,铜片表面产生无色气体,在液面上方变为红棕色。 |
实验Ⅱ | 15 mol·L-1浓硝酸 | 电流计指针先向右偏转,很快又偏向左边,铝片和铜片表面产生红棕色气体,溶液变为绿色。 |
(1)实验Ⅰ中,铝片作_____(填“正”或“负”)极。液面上方产生红棕色气体的化学方程式是_________。
(2)实验Ⅱ中电流计指针先偏向右边后偏向左边的原因是____________________。
查阅资料:活泼金属与1 mol·L-1稀硝酸反应有H2和NH4+生成,NH4+生成的原理是产生H2的过程中NO3-被还原。
(3)用上图装置进行实验Ⅲ:溶液X为1 mol·L-1稀硝酸溶液,观察到电流计指针向 右偏转。
①反应后的溶液中含NH4+。实验室检验NH4+的方法是______________________________。
②生成NH4+的电极反应式是_____________________________________________。
(4)进一步探究碱性条件下NO3-的氧化性,进行实验Ⅳ:

①观察到A中有NH3生成,B中无明显现象。A、B产生不同现象的解释是_______________。
②A中生成NH3的离子方程式是_______________________________。
(5)将铝粉加入到NaNO3溶液中无明显现象,结合实验Ⅲ和Ⅳ说明理由_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com