
����Ŀ��1.52gͭþ�Ͻ���ȫ�ܽ���50mL�ܶ�Ϊ1.40gmL��1����������Ϊ63%��Ũ�����У��õ�NO2��N2O4�Ļ������ 1 120mL����״��������Ӧ�����Һ�м���1.0molL��1NaOH��Һ������������ȫ������ʱ���õ�2.54g����������˵������ȷ���ǣ� ��
A���úϽ���ͭ��þ�����ʵ���֮����1��2
B����Ũ������HNO3�����ʵ���Ũ����14.0 molL��1
C��NO2��N2O4�Ļ�������У�NO2�����������80%
D���õ�2.54 g����ʱ������NaOH��Һ�������640 mL
���𰸡�A
��������
���������A����Ͻ���Cu��Mg�����ʵ����ֱ�Ϊx��y��������Ŀ������Ϣ֪x��64 g/mol��y��24 g/mol��1.52g�٣������ΪM���ڷ�Ӧ�������У�M��ne��===Mn����Mn����OH��===M(OH)n�����Ӷ����Կ�������������ʧȥ���ӵ����ʵ������ڽ�����������ȫ��������OH�������ʵ����������������ʵ����ǣ�2.54g��1.52g����17g/mol��0.06mol����2x��2y��0.06 mol�ڣ��ɢ٢ڽ��x��0.02 mol��y��0.01 mol��A����B�������Ũ����![]() ��14.0mol/L��B��ȷ��C��������������֪��Cu��Mg��ʧȥ0.06 mol���ӣ����ݵ�ʧ�����غ�֪�����������ȫ����ԭΪNO2��NO2�����ʵ���ӦΪ0.06 mol���ֵõ�0.05 mol������壬������2NO2
��14.0mol/L��B��ȷ��C��������������֪��Cu��Mg��ʧȥ0.06 mol���ӣ����ݵ�ʧ�����غ�֪�����������ȫ����ԭΪNO2��NO2�����ʵ���ӦΪ0.06 mol���ֵõ�0.05 mol������壬������2NO2![]() N2O4���ɲ����������N2O4Ϊ0.01 mol����NO2Ϊ0.04 mol��NO2�����������80%��C��ȷ��D���õ�2.54 g����ʱ����������������������غ��֪��������0.05L��14mol/L��0.06mol��0.64mol��������0.64 mol NaOH�������Ϊ640 mL��D��ȷ����ѡA��
N2O4���ɲ����������N2O4Ϊ0.01 mol����NO2Ϊ0.04 mol��NO2�����������80%��C��ȷ��D���õ�2.54 g����ʱ����������������������غ��֪��������0.05L��14mol/L��0.06mol��0.64mol��������0.64 mol NaOH�������Ϊ640 mL��D��ȷ����ѡA��


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ѧ��ȤС����ʵ�������ü�����������Ӧ��ȡ����Ʒ���ᣬ����Ƶ�װ�����£�
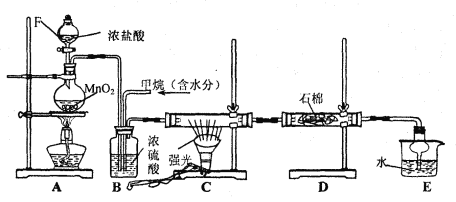
����Ҫ����գ�
(1) д��CH4��Cl2����һ�ȴ���Ļ�ѧ��Ӧ����ʽ ��
(2) Bװ�������ֹ��ܣ��������������٣����������Ͼ��ȣ���________________��
(3) Dװ���е�ʯ����������KI����Һ��KI��ĩ���������� ��
(4) Eװ�õ�������____________(����)��
A���ռ����� B����ֹ���� C���������� D�������Ȼ���
(5) Eװ���г��������������⣬�������л����E�з�����������ѷ���Ϊ ��
(6) ��װ�û���ȱ��,ԭ����û�н���β������,��β������Ҫ�ɷ���___________(����)��
A��CH3Cl B��CH2Cl2 C��CHCl3 D��CCl4 E��CH4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��[��ѧ����ѡ��3�����ʽṹ������]�������ڹ���Ԫ��Fe��Ti����C��H��N��O�γɶ��ֻ����
��1����H��C��N��O����Ԫ�صĵ縺����С�����˳��Ϊ ��
��������������ȷ���� ��������ĸ��
A����ΪHCHO��ˮ���Ӽ����γ����������CH2O������ˮ
B��HCHO��CO2�����е�����ԭ�Ӿ�����sp2�ӻ�
C��C6H6�������6��![]() ����1����
����1����![]() ����C2H2�ǷǼ��Է���
����C2H2�ǷǼ��Է���
D��CO2������۵㡢�е㶼�ȶ������辧��ĵ�
�����ᣨHOCN����һ����״���ӣ����������ᣨHNCO����Ϊͬ���칹�壬������ڸ�ԭ���������Ѵﵽ�ȶ��ṹ����д������Ľṹʽ ��
(2) Feԭ�ӻ�������Χ�н϶���������Ŀչ������һЩ���ӻ������γ�����
����Feԭ�ӻ������γ������ķ��ӻ�����Ӧ�߱��Ľṹ������
���������������[Fe(CN)6]4 -����� ��
A�����ۼ�
B���Ǽ��Լ�
C�����
D���Ҽ�
E���м�
д��һ���� CN- ��Ϊ�ȵ�����ĵ��ʷ���ʽ ��
��3������Ԫ��ԭ�ӵ���Χ�����Ų��������ɽ����ڱ��ֳ������������Ti���� ����
��4��һ��Al��Fe�Ͻ�����徧������ͼ��ʾ����ݴ˻ش��������⣺
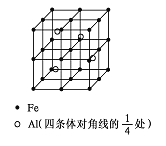
�� ȷ���úϽ�Ļ�ѧʽ ��
����������ܶȣ��� g/cm3����˺Ͻ������������Feԭ��֮��ľ���(�ú��ѵĴ���ʽ��ʾ�����ػ���)Ϊ cm��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Һ���ɲ���������ܵõ�ԭ��Һ�����ʵ���
A. �Ȼ�����Һ B. ̼������Һ C. ����������Һ D. ���������Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����100mL 1.00mol��L-1������100mL 1.10mol��L-1NaOH��Һ������ͼ��ʾ��װ���н����к��Ȳⶨʵ�����������Ĵ�ʵ�������������ش��������⣺
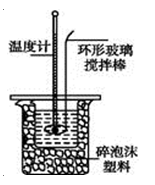
ʵ�� ���� | ������ʼ�¶�t1/�� | ����������ʼ�¶�t2/�� | ����Һ��Ϻ� �¶�t3/�� |
1 | 21.0 | 21.1 | 26.9 |
2 | 21.5 | 21.7 | 28.2 |
3 | 21.9 | 22.1 | 28.7 |
4 | 22.3 | 22.5 | 29.2 |
��1���ϱ��е����Ȳ�ƽ��ֵΪ ��
��2��������Ϊ����������Һ���ܶȶ���1 g��cm-3���кͺ�������Һ�ı�����c=4.18J��(g����)-1�������õ��к�����H= ��ȡС�����һλ����
��3������ʵ����ֵ�����57.3 kJ��mol-1��ƫ�����ƫ���ԭ������ǣ�����ĸ�� ��
a��ʵ��װ�ñ��¡�����Ч����
b���û���ͭ�ʽ�������滷�β��������
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨ������Һ��ʼ�¶Ⱥ�ֱ�ӲⶨNaOH��Һ���¶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����װ��M���Թ��м����ͨ��N�������Թ��ڻ��г�������
A | B | C | D | |
M | Ca(OH)2��Һ | AlCl3��Һ | NaAlO2��Һ | Mg(OH)2����Һ |
N | CO2 | ��ˮ | ���� | NH4Cl������Һ |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���Ʊ������������壬���ˮ����εμ� ��Һ������������ Ϊֹ��д���йط�Ӧ�Ļ�ѧ����ʽ ��
��2������÷�ɢϵ��μ���������Һ�������������һϵ�б仯������Ϊ ���������
A�������Ա仯 B�����ֺ��ɫ���� C�����ɫ�����ܽ�
д���йص����ӷ���ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£�NH3��H2S������ܶȱ���______________��ͬ������NH3��H2S������������______________��ͬ��ͬ�ܶ�ͬ�����NH3��H2S����������H��������______________������������H������ȣ����ǵ����ʵ���֮����______________��ͬ��ͬ����£�ͬ������NH3��H2S�����ѹǿ֮����__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ���˵����ȷ����
A. ��ʪ���pH��ֽ��ϡ�����pH
B. ����ʽ�ζ�����ȡ20.00 mL����K2Cr2O7��Һ
C. ��������ƽ��ȡ5.85 gNaCl����
D. �ô�ĥ�ڲ��������Լ�ƿ����Na2CO3��Һ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com