
| A | B | C | D | I | |||||||||||||
| E | F | G | H | M | |||||||||||||
| J | K | ||||||||||||||||
| L | |||||||||||||||||
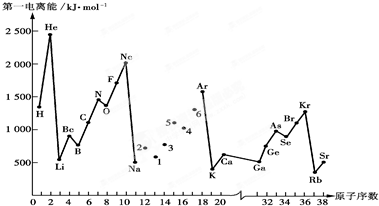
| ||
| ||
| ||
 ;
; ;
;

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,0.1molCl2溶于水,转移的电子数目为0.1NA |
| B、常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA |
| C、某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| D、标准状态下,33.6L氟化氢中含有氟原子的数目为1.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氢的三种同位素:H2、D2、T2 |
B、F-的结构示意图: |
| C、中子数为20的氯原子:2017Cl |
D、NH3的电子式: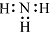 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.01mol/LNH4Al(SO4)2溶液与0.02mol/LBa(OH)2溶液等体积混合:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| B、氯气通入水中:Cl2+H2O=Cl-+ClO-+2H+ |
| C、Ca(HCO3)2溶液中滴加过量的NaOH溶液:Ca2++HCO3-+OH-=CaCO3↓+H2O |
| D、用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据元素组成知它是化合物 |
| B、因为含有钾元素与硫酸根,故KHSO4是钾盐 |
| C、KHSO4可以称为酸式盐 |
| D、因为它含有与酸相同的元素氢,故KHSO4也可称为酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、根据酸分子中含有的H原子个数将酸分为一元酸,二元酸和多元酸 |
| B、根据反应中是否有离子参加化学反应分为离子反应和非离子反应 |
| C、根据水溶液是否能够导电,将物质分为电解质和非电解质 |
| D、根据是否含有氧元素,将物质分为氧化剂和还原剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、若M(甲)<M(乙),则分子数:甲<乙 |
| B、若M(甲)>M(乙),则气体摩尔体积:甲<乙 |
| C、若M(甲)<M(乙),则气体的压强:甲>乙 |
| D、若M(甲)<M(乙),则气体的体积:甲<乙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Ⅰ、某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%.
Ⅰ、某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%.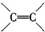
| 稀、冷KMnO4/OH- |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com