
 Ⅰ、某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%.
Ⅰ、某含苯环的化合物A,其相对分子质量为104,碳的质量分数为92.3%.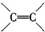
| 稀、冷KMnO4/OH- |

 ,根据等效氢判断一氯代物个数;
,根据等效氢判断一氯代物个数;| 104g×92.3% |
| 12g/mol |
| 104g×(1-92.3%) |
| 1g/mol |
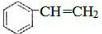 ,与溴发生加成反应生成
,与溴发生加成反应生成 ,则反应的方程式为
,则反应的方程式为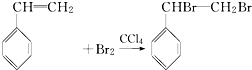 ,
, ;
; 可知生成
可知生成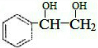 ,
, 和足量乙酸反应生成酯,反应的方程式为
和足量乙酸反应生成酯,反应的方程式为 ,
, ;
; ,故答案为:
,故答案为: ;
; ,环上有4种氢,乙基上有2种氢,共6氢,故一氯代物有6种,故答案为6;
,环上有4种氢,乙基上有2种氢,共6氢,故一氯代物有6种,故答案为6;

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| A | B | C | D | I | |||||||||||||
| E | F | G | H | M | |||||||||||||
| J | K | ||||||||||||||||
| L | |||||||||||||||||
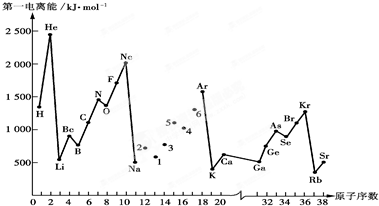
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、非金属单质燃烧时火焰均为无色 |
| B、NaCl与Na2CO3灼烧时火焰颜色相同 |
| C、焰色反应均应透过蓝色钴玻璃观察 |
| D、只有金属单质灼烧时火焰才有颜色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纯净物只由一种元素组成,而混合物由两种或两种以上元素组成 |
| B、纯净物只由一种原子组成,而混合物由多种原子组成 |
| C、只由一种分子组成的物质一定为纯净物,组成混合物的物质可能只有一种元素 |
| D、只由一种元素的阳离子与另一种元素的阴离子组成的物质一定为纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
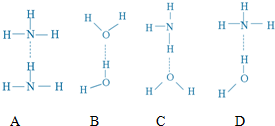
| 物质 | H2 | N2H4 | H2NN(CH3)2 |
| 沸点/℃ | -252.8 | 113.5 | ~116 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
A、K=
| ||
B、K=
| ||
C、K=
| ||
D、K=
|
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com