


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
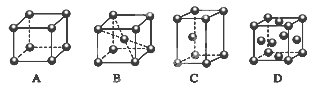
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

| A.离子键 | B.共价键 | C.配位键 | D.金属键 |
查看答案和解析>>
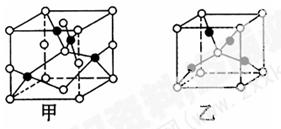
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
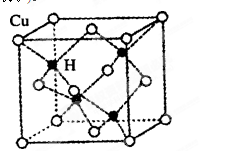
科目:高中化学 来源:不详 题型:单选题
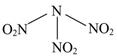
| A.分子中N、O间形成的共价键是非极性键 | B.分子中四个氮原子共平面 |
| C.该物质既有氧化性又有还原性 | D.15.2 g该物质含有6.02×1022个原子 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 图a
图a| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |


查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 元素 | Mn | Fe | |
| 电离能 /kJ·mol-1 | I1 | 717 | 759 |
| I2 | 1 509 | 1 561 | |
| I3 | 3 248 | 2 957 | |
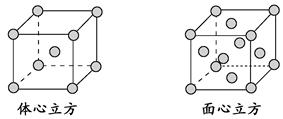
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com