
 图a
图a| | BeCO3 | MgCO3 | CaCO3 | SrCO3 | BaCO3 |
| 分解温度 | 100℃ | 540℃ | 960℃ | 1289℃ | 1360℃ |


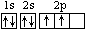 (1分);(2)CF4(1分);109°28′(1分)
(1分);(2)CF4(1分);109°28′(1分)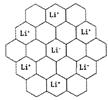 (2分)
(2分)  (2分)
(2分) 。
。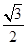 a2b×10-21cm3,故锂电池负极材料的密度为
a2b×10-21cm3,故锂电池负极材料的密度为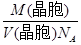 =
= g·cm-3。
g·cm-3。

 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源:不详 题型:单选题
| A.酸性H4SiO4<H3PO4<H2SO4<HClO4 |
| B.碱性Ca(OH)2>Mg(OH)2>Al(OH)3 |
| C.稳定性SiH4>NH3>H2O>HF |
| D.半径O2->F->Mg2+>Al3+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
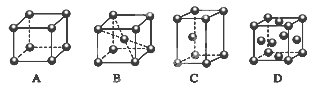
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
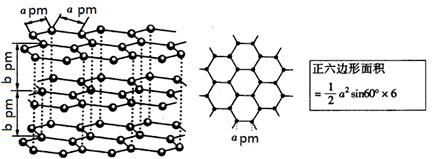
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

 OHC-CH2CH2OH。
OHC-CH2CH2OH。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
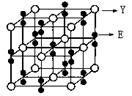
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A原子核外电子分占3个不同能级,且每个能级上排布的电子数相同 |
| B元素原子的核外p电子总数比s电子总数少1 |
| C原子p轨道上成对电子数等于未成对电子数,且与A同周期 |
| D元素的族序数与周期数的差为4,且不与A元素在同一周期 |
| E位于周期表中第七列 |
| F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com