
如图是NaCl、MgSO4的溶解度曲线。下列说法正确的是 ( )

A.只有在t1 ℃时,NaCl和MgSO4的溶解度才相等
B.t1~t2 ℃,MgSO4的溶解度随温度升高而减小
C.在t2 ℃时,MgSO4饱和溶液的溶质质量分数最大
D.把MgSO4饱和溶液的温度从t3 ℃降至t2 ℃时,有晶体析出
科目:高中化学 来源:2014高考化学二轮专题突破 专题十一常见金属元素练习卷(解析版) 题型:选择题
工业上冶炼金属一般用热分解法、热还原法和电解法,不同的金属应选用不同的冶炼方法。选择的原则主要是依据( )
A.金属在地壳中的丰度
B.金属在自然界中的存在形式
C.金属的还原性强弱
D.金属的利用价值
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题二化学用语及常用计量练习卷(解析版) 题型:实验题
某学生利用高锰酸钾分解制氧气的反应,测定室温下的气体摩尔体积,实验装置如下。
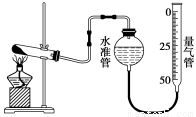
部分实验步骤:①装好实验装置。② _。
③把适量的高锰酸钾粉末放入干燥的试管中,准确称量试管和高锰酸钾粉末的质量为
a g。④加热,开始反应,直到产生一定量的气体。⑤停止加热。⑥测量收集到的气体的体积。⑦准确称量试管和残留物的质量为b g。⑧测量实验室的温度。回答下列问题。
(1)实验步骤的第②步是 _。
(2)以下是测量收集到的气体的体积时必须包括的几个步骤:①调整量气管高度,使其液面高度与水准管液面高度相平;②使装置内的气体都冷却至室温;③读取量气管中气体的体积。这三步操作的正确顺序是 (请填写步骤代号)。
(3)如果实验中得到的氧气体积是c L,水蒸气的影响忽略不计,则室温下气体摩尔体积的计算式为 (含a、b、c)。
(4)分析下列因素对实验结果的影响(假定其他操作均正确),并在横线上填“偏大”、“偏小”或“无影响”。
①高锰酸钾未完全分【解析】
_。
②实验前未将装置内的空气排出: _。
③未恢复至室温就读数: _。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题九化学反应速率化学平衡练习卷(解析版) 题型:选择题
某温度时,在密闭容器中,X、Y、Z三种气体浓度的变化如图Ⅰ所示,若其它条件不变,当温度分别为T1和T2时,Y的体积分数与时间关系如图Ⅱ所示。则下列结论正确的是( )
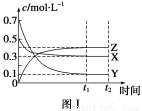
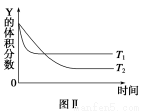
A.该反应的热化学方程式为X(g)+3Y(g)  2Z(g) ΔH>0
2Z(g) ΔH>0
B.若其它条件不变,升高温度,正、逆反应速度均增大,X的转化率减小
C.达到平衡后,若其他条件不变,减小容器体积,平衡向逆反应方向移动
D.达到平衡后,若其他条件不变,通入稀有气体,平衡向正反应方向移动
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:填空题
已知硫酸、氨水的密度与所加水的量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
| 溶质的物质的量 浓度/mol·L-1 | 溶液的密度/g·cm-3 |
硫酸 | c1 | ρ1 |
氨水 | c2 | ρ2 |

(1)表中硫酸的质量分数为________(不写单位,用含c1、ρ1的代数式表示)。
(2)物质的量浓度为c1 mol·L-1的硫酸与水等体积混合(混合后溶液的体积变化忽略不计),所得溶液的物质的量浓度为________ mol·L-1。
(3)将物质的量浓度分别为c2 mol·L-1和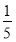 c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________
c2 mol·L-1的氨水等质量混合,所得溶液的密度________(填“大于”、“小于”或“等于”,下同)ρ2 g·cm-3,所得溶液的物质的量浓度________ 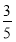 c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
c2 mol·L-1(设混合后溶液的体积变化忽略不计)。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题三溶液组成的计量及其应用练习卷(解析版) 题型:选择题
一定量的铜和浓硫酸在加热条件下充分反应,向反应后的溶液中逐滴加入含a mol NaOH的溶液,恰好使反应后的溶液呈中性,则下列叙述错误的是( )
A.溶液中c(Na+)=2c(SO42-)
B.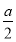 mol>沉淀的物质的量>0
mol>沉淀的物质的量>0
C.沉淀的物质的量=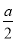 mol
mol
D.原浓硫酸中H2SO4的物质的量>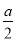 mol
mol
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题七化学反应与能量练习卷(解析版) 题型:填空题
(1)生产水煤气过程中有以下反应:①C(s)+CO2(g)??2CO(g) ΔH1;
②CO(g)+H2O(g)  H2(g)+CO2(g) ΔH2;
H2(g)+CO2(g) ΔH2;
③C(s)+H2O(g)  CO(g)+H2(g) ΔH3;
CO(g)+H2(g) ΔH3;
上述反应ΔH3与ΔH1、ΔH2之间的关系为__________________________________。
(2)将CH4转化成CO,工业上常采用催化转化技术,其反应原理为
2CH4(g)+3O2(g)  2CO(g)+4H2O(g)
2CO(g)+4H2O(g)
ΔH=-1 038 kJ·mol-1。
工业上要选择合适的催化剂,分别对X、Y、Z三种催化剂进行如下实验(其他条件相同):
①X在750 ℃时催化效率最高,能使正反应速率加快约3×105倍;
②Y在600 ℃时催化效率最高,能使正反应速率加快约3×105倍;
③Z在440 ℃时催化效率最高,能使逆反应速率加快约1×106倍;
根据上述信息,你认为在生产中应该选择的适宜催化剂是________(填“X”或“Y”或“Z”),选择的理由是________________________________________________________;
(3)请画出(2)中反应在有催化剂与无催化剂两种情况下反应过程中体系能量变化示意图,并进行必要标注。
查看答案和解析>>
科目:高中化学 来源:2014高考化学二轮专题突破 专题一物质的组成性质和分类练习卷(解析版) 题型:选择题
下图是某反应在密闭容器中反应前后的分子状况示意图,“●”和“○”分别表示不同的原子。下列对该过程的相关描述正确的是( )
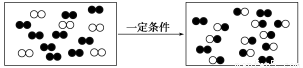
A.有一种物质过量 B.发生的是分解反应
C.发生的是置换反应 D.生成了两种产物
查看答案和解析>>
科目:高中化学 来源:2014高考化学专题突破训练 专题7电解质溶液练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.常温下醋酸分子不可能存在于pH>7的碱性溶液中
B.常温下向氯化铵溶液中加入少量氨水使溶液的pH=7,则混合溶液中c(N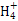 )>c(Cl-)
)>c(Cl-)
C.0.1 mol·L-1的氯化铵溶液与0.05 mol·L-1的氢氧化钠溶液等体积混合后溶液中离子浓度的大小关系是:c(Cl-)>c(N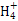 )>c(Na+)>c(OH-)>c(H+)
)>c(Na+)>c(OH-)>c(H+)
D.0.1 mol·L-1硫化钠溶液中离子浓度的关系:c(Na+)=c(S2-)+c(HS-)+c(H2S)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com