
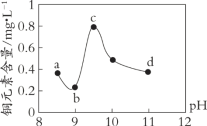
【题目】某电路板生产企业的水质情况及国家允许排放的污水标准如下表所示。为研究废水中Cu2+处理的最佳pH,取5份等量的废水,分别用30%的NaOH溶液调节pH至8.5、9、9.5、10、11,静置后,分析上层清液中铜元素的含量,实验结果如下图所示。
查阅资料,平衡I:Cu(OH)2 + 4NH3 ![]() [Cu(NH3)4]2+ + 2OH-;
[Cu(NH3)4]2+ + 2OH-;
平衡II:Cu(OH)2 + 2OH- ![]() [Cu(OH-)4]2-
[Cu(OH-)4]2-
项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+/ mg·L-1 | 72 | ≤0.5 |
NH4+/ mg·L-1 | 2632 | ≤15 |
下列说法不正确的是
A. 废水中Cu2+处理的最佳pH约为9
B. b~c段:随pH升高,Cu(OH)2的量增加,平衡I正向移动,铜元素含量上升
C. c~d段:随pH升高,c(OH-)增加,平衡I逆向移动,铜元素含量下降
D. d点以后,随c(OH-)增加,铜元素含量可能上升
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 石灰乳与过量碳酸氢钙溶液反应:HCO3—+Ca2++OH-==CaCO3↓+H2O
B. 向沸水中滴加饱和FeCl3溶液制备Fe(OH)3胶体:Fe3++3H2O(沸水)![]() Fe(OH)3(胶体)+3H+
Fe(OH)3(胶体)+3H+
C. 二氧化碳通入足量的氢氧化钠溶液:CO2 + OH-═ HCO3-
D. 氧化钠与盐酸反应:O2-+2H+ ==== H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示两个常见固氮反应的平衡常数对数值(lgK)与温度的关系:①N2+3H22NH3;②N2+O22NO。根据图中的数据判断下列说法正确的是

A.升温,反应①的速率减小反应②的速率增大
B.反应①是放热反应
C.可以在常温下利用反应①进行工业固氮
D.曲线的交点表示反应①和反应②体系中 N2 的转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL 0.1 mol·L-1CH3COOH溶液中滴加0.1mol·L-1的NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。下列说法中错误的是( )
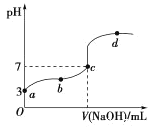
A.c点对应的V(NaOH)<20mL
B.a点表示的溶液中由水电离出的H+浓度为1.0![]() 10-11mol·L-1
10-11mol·L-1
C.b点表示的溶液中 c(CH3COO -)>c(Na+)
D.b、d点表示的溶液中c(CH3COO-)与c(CH3COOH)的比值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl3具有净水作用,而高铁酸钠(Na2FeO4)易溶于水,是一种新型多功能水处理剂,处理污水比FeCl3高效。请回答下列问题:已知25℃,Ksp[Fe(OH)3]=4.0×10-38,lg2=0.3
(1)FeCl3净水的原理是______。(用离子方程式表示),Fe3+水解生成的Fe(OH)3胶体粒子能吸附水中的悬浮杂质,常温下此反应的平衡常数为______(填写数值)。
(2)25℃时pH=3的溶液中,Fe3+浓度的最大值为c(Fe3+)=______molL-1。
(3)FeCl3在溶液中分三步水解:
Fe3++H2OFe(OH)2++H+ K1
Fe(OH)2++H2O![]() +H+ K2
+H+ K2
![]() +H2OFe(OH)3+H+ K3
+H2OFe(OH)3+H+ K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是_________。通过控制条件,以上水解产物聚合,生成聚合氧化铁,离子方程式为:xFe3++yH2O![]() +yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
+yH+,欲使平衡正向移动可采用的方法是(填序号)__________。
a.降温 b.加水稀释 c. 加入NaHCO3d.加入NH4Cl
(4)从环境保护的角度看,制备Na2FeO4较好的方法为电解法,其装置如图所示:
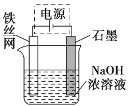
①电解过程中阳极的电极反应式为______。
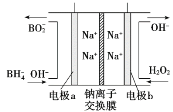
②图甲装置中的电源采用NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,电源工作原理如图所示。电极a与甲池中_______(填“石墨”或“铁丝网”)连接,电极b的反应式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】T ℃时在2 L的密闭容器中X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的浓度变化如图1所示;若保持其他条件不变,反应温度分别为T1和T2时,Y的体积分数与时间的关系如图2所示。则下列结论正确的是
 A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
A.反应进行的前3 min内,用X表示的反应速率v(X)=0.3 mol·(L·min)-1
B.容器中发生的反应可表示为3X(g)+Y(g) ![]() 2Z(g)
2Z(g)
C.保持其他条件不变,升高温度,反应的化学平衡常数K减小
D.若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:2NO2(g) ![]() 2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO(g)+O2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2、NO、O2表示的反应速率的比为2∶2∶1的状态
④混合气体的颜色不再改变的状态
⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
A.①③⑥⑦B.①④⑥⑦C.②③④⑦D.①②④⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 ℃、20 MPa时,将H2和N2置于一容积为2 L的密闭容器中发生反应。反应过程中H2、N2和NH3的物质的量变化如下图所示,下列说法中正确的是( )

A.从反应开始到第一次平衡时,N2的平均反应速率为0.005 mol·L-1·min-1
B.平衡在10 min至20 min的变化,可能是因为增大了容器体积
C.25 min时,分离出了0.1 mol NH3
D.在25 min后平衡向正反应方向移动,新平衡中NH3的体积分数比原平衡的大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与盐的水解有关的是
① ![]() 与
与 ![]() 溶液可作焊接金属中的除锈剂 ②用
溶液可作焊接金属中的除锈剂 ②用 ![]() 与
与 ![]() 两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放
两种溶液可作泡沫灭火剂 ③草木灰与铵态氮肥不能混合施用 ④实验室盛放 ![]() 溶液的试剂瓶不能用磨口玻璃塞
溶液的试剂瓶不能用磨口玻璃塞
A.①②③B.②③④C.①④D.①②③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com